Процессы мышления, памяти, скорость визуальной и моторной реакции, одним словом все, что принято включать в оценку состояния мозговых функций, имеет огромное значение в спорте. Оптимальное состояние центральной (ЦНС) и периферической (ПНС) нервной системы обеспечивает адекватную реакцию исполнительных органов, включая скелетную мускулатуру, гормональную и биохимическую адаптацию организма к физическим нагрузкам. Степень адаптации определяет и дальнейшие процессы: скорость развития утомления (снижение способности воспроизводить те же движения, что и в начале тренировки, падение реакции и координации и т.д.); длительность периода восстановления; способность на том же уровне проводить следующий цикл тренировок и многое другое. С возрастом адаптационные возможности снижаются, и у спортсменов старшей возрастной группы требуются дополнительные усилия для сохранения концентрации и реакции на внешние стимулы, большее время на принятие оптимальных решений. Снижение когнитивных функций отражается и на способности переносить нагрузки: чем точнее оценка ситуации, выше скорость выполнения упражнений, тем меньше (экономнее) энергозатраты спортсмена и больше потенциальный объем выполняемой работы. Иными словами, умный и быстро мыслящий спортсмен имеет преимущество перед спортсменом с затуманенным сознанием и вялой реакцией. Можно ли противостоять развитию нейромышечной усталости и снижению когнитивных функций, сохранив свежесть ума и реакции на протяжении длительного периода, и быть полностью готовым к полноценным тренировкам и соревнованиям уже на следующий день? Разрешенные к применению в спорте (не входящие в список WADA) нейротропные БАДы включают вещества как быстрого (немедленного) действия (специфические), так и с отсроченным (метаболически обусловленным) эффектом. Последний (проявляется через дни, недели и месяцы применения и, в большинстве случаев, носит неспецифический характер. Международное Общество Спортивного Питания (ISSN) в течение нескольких лет прицельно анализирует БАДы, которые применяются в спортивной медицине как профессиональными спортсменами, так и просто любителями занятий в фитнес-центрах, с целью улучшения параметров умственной деятельности и других функций ЦНС.
Согласно публикации Krissy Kendall (“Bodybuilding.com”, 25 мая 2016) существует несколько групп БАДов, которые потенциально способны улучшать функции мозга у тренирующихся лиц (с очень разной доказательной базой): 1) производные холина и аналоги (цитиколин; альфа-глицерил-фосфорилхолин – A-GPC); 2) фосфатидил-серин – PS), естественный метаболит организма, выполняющий целый ряд функций, включая улучшение памяти, внимания, поддержание реакции и торможение развития усталости; 3) производные пурина – кофеин и природные источники, его содержащие; 4) полифенолы (ресвератрол, Гинкго Билоба и др.); 5) L-теанин (L-theanine) – небелковая аминокислота листьев зеленого чая; снижает реакцию мозга на экстремальные стрессорные воздействия; 6) хуперцин А (huperzine A) – популярный растительный ноотроп – повышает уровень ацетилхолина в мозге, и некоторые другие.
Указанные группы разрешенных к применению стимуляторов мозговой деятельности имеют различный доказательный уровень – от категории «А» (высшая степень доказательности) до категории «С» и «D» (самый низкий уровень доказательности). Далее в этой главе мы подробно рассмотрим доказательную базу для каждой группы веществ.
С практической точки зрения, улучшение когнитивных функций достоверно обеспечивают и другие известные вещества и пищевые добавки, такие как креатин, дипептиды L-глутамина, омега-3 ПНЖК и некоторые другие. Однако, их действие на функциональное состояние мозговой ткани является, скорее всего, вторичным и, главное, не основным в общем спектре фармакологической активности. Их свойства описаны в отдельных главах настоящего «Руководства по спортивной нутрициологии» и не являются предметом рассмотрения в настоящей статье.
Следует также отметить, что достаточно мощные нейрогенные стимуляторы природного и синтетического происхождения запрещены для применения в спорте и входят в соответствующие списки WADA (см. лист запрещенных субстанций на 2017 год): группа S6 (стимуляторы неспецифические и специфические); S8 – каннабиноиды. Особое внимание следует обратить на вещество оксилофрин (Метилсинефрин — группа S6 – специфические стимуляторы), которое до 2016 года, несмотря на запрет WADA, входило в состав ряда продуктов спортивного питания в США. Продукты с оксилофрином производились, распространялись и применялись в различных видах спорта, что послужило предметом специального разбирательства в официальных регулирующих органах (FDA, Сенат США и др.). Этот вопрос, как и ряд других, рассмотрен в специальной главе настоящего Руководства «Проблемное спортивное питание».
Другой, не менее значимой группой веществ, являются нейропротекторы. Нейропротекторы повышают устойчивость мозговой ткани к травмирующим стрессорным воздействиям в таких контактных видах спорта как бокс, американский футбол, регби, ряд других силовых единоборств, в которых могут возникать острые или хронические травмы головного мозга с ближайшими или отдаленными последствиями. Зачастую такими нейропротективными свойствами обладают и стимуляторы мозговой деятельности из вышеописанных групп. Включение нейропротекторов в состав комплексной НМП является целесообразной мерой и должно производиться на основе имеющихся научных и клинических исследований эффективности и безопасности.
Производные холина и аналоги

холин
Основополагающим веществом этой группы является холин [(2-гидроксиэтил)триметиламмоний], катион 2-гидроксиэтилтриметиламмония, [(CH3)3N+CH2CH2OH] X−.
Относится к водорастворимым витаминам группы В (В4). В организме из холина под влиянием холин-ацетилтрансферазы образуется ацетилхолин, являющийся передатчиком (нейромедиатором) нервных импульсов в ЦНС и ПНС. Функционирование холинергических систем мозга в совокупности с другими нейромедиаторными системами, определяет все основные параметры деятельности мозга.
Сам по себе холин является добавкой, разрешенной к применению в большинстве стран мира в составе лекарственных препаратов и БАДов. Научная точка зрения на холин в Европе определена документом Европейского Общества по безопасности пищи» (EFSA) с длинным названием «Scientific Opinion on the substantiation of health claims related to choline and contribution to normal lipid metabolism (ID 3186), maintenance of normal liver function (ID 1501), contribution to normal homocysteine metabolism (ID 3090), maintenance of normal neurological function (ID 1502), contribution to normal cognitive function (ID 1502), and brain and neurological development (ID 1503) pursuant to Article 13(1) of Regulation (EC) No 1924/2006». Согласно этому документу, Европейской Комиссией для холина признаны с точки зрения доказательной медицины следующие направления: нормализация метаболизма липидов; поддержание нормальной функции печени; оптимизация обмена аминокислоты гомоцистеина; нормализация неврологических функций организма; улучшение когнитивных функций; стимуляция развития мозговых структур. Специально для влияния холина на функции нервной системы выделены следующие показания (выписка из документа):
Таблица 1. Свойства холина как составной части пищевых продуктов в плане регуляции нервной деятельности
| Направленность действия | Предлагаемые формулировки для продукции, содержащей холин |
|---|---|
| Когнитивные функции, память, неврологические показатели Повышение функциональной активности мозга за счет улучшение передачи импульсов между нейронами мозга. Входит в состав нейромедиаторов. Улучшает память, способность к обучению и концентрацию внимания. Предотвращает нейродегенеративные процессы в ЦНС под влиянием стрессорных и патогенных факторов. | — Холин поддерживает нормальное функционирование нервной системы — Холин поддерживает передачу нервных импульсов — Холин поддерживает когнитивные функции — Холин помогает поддерживать память и функции мозга |
| Суточная доза для спортсменов – 100 мг; для обычных людей 45 мг (15% от минимальной терапевтической дозы 300 мг); минимальная суточная доза 20 мг. | |
| Развитие Незаменимый нутриент для функции мозговой ткани и периферической нервной системы. Стимулирует развитие ЦНС и памяти (входит в группу витаминов В). Несмотря на синтез в небольшом количестве в организме, должен поступать с пищей для поддержания здоровья. | — Холин является незаменимым нутриентом для нормального развития, особенно мозга и нервной системы |
| Суточная доза для этапа развития ЦНС и ПНС 20 мг; содержание в функциональной пище – не менее 20 мг | |
Цитиколин
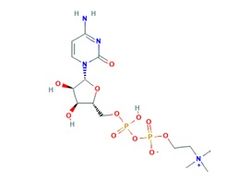
Рис.1. Структура цитиколина. Формула: C14H27N4O11P2+
Цитиколин – (CDP-холин; цитидин 5’-ди-фосфохолин) природное вещество, широко применяемое в различных странах в качестве БАДа (пищевой добавки). Экзогенное введение цитиколина влияет на клеточный метаболизм мозга, улучшая когнитивные функции и оказывая нейропротекторное действие как в доклинических, так и в клинических исследованиях (J.J.Secades, J.L.Lorenzo, 2006; R.Ozay и соавт., 2007; V. Parisi и соавт., 2008). Сочетая в структуре холин и цитидин, цитиколин участвует в синтезе фосфолипидов клеточных мембран, восстанавливая их структуру (J.J.Secades, J.L.Lorenzo, 2006; R.Conant, A.G.Schauss, 2004) и обеспечивая источник холина для образования нейромедиатора ацетилхолина (AЦХ) и синтеза фосфатдихолина (I.H.Ulus и соавт., 1989; J.J.Secades, J.L.Lorenzo, 2006).
Фармакокинетика и метаболизм цитиколина
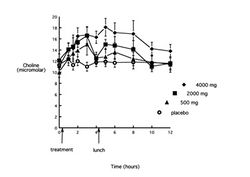
Рис.2. Динамика концентрации холина в плазме крови (ось ординат, микромол) после приема внутрь цитиколина в дозах 500 мг (треугольники), 2000 мг (квадраты), 4000 мг (ромбы) и плацебо (светлые кружки). По оси абсцисс – время в часах после приема.
Подробное исследование фармакокинетики цитиколина у человека при пероральном введении в различных дозах выполнено R.J.Wurtman и соавторами (2000). Цитиколин принимался натощак в дозах 500, 2000 и 4000 мг (в сравнении с плацебо). Образцы крови на содержание холина, уридина и цитидина брались через 1, 1.5, 2, 3, 4, 5, 6, 8, 10 и 12 часов после приема цитиколина.
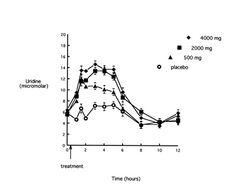
Рис.3. Динамика концентрации уридина в плазме крови (ось ординат, микромол) после приема внутрь цитиколина в дозах 500 мг (треугольники), 2000 мг (квадраты), 4000 мг (ромбы) и плацебо (светлые кружки). По оси абсцисс – время в часах после приема.
Цитиколин после приема внутрь абсорбируется практически полностью и достаточно быстро. Он метаболизирует в печени с образованием холина и цитидина, однако у человека основными метаболитами при энтеральном приеме цитиколина в процессе абсорбции в кишечнике являются холин и уридин, которые и служат циркулирующими в крови главными маркерами при исследовании фармакокинетики цитиколина. Как видно из рис.2, прием цитиколина приводит к значимому (P<0,05) дозо-зависимому увеличению площади под кривой «концентрация холина-время» (AUC). Пик концентрации холина наблюдался через 2-3 часа после приема дозы 500 мг и через 5 часов после приема других доз. Величина возрастания была 23, 32 и 43% для доз 500, 2000 и 4000 мг, соответственно (P<0.001), а продолжительность повышения для дозы 500 мг составила 4 часа, 2000 мг – 6-8 часов, 4000 мг – 8-10 часов. Прием цитиколина достоверно (P<0,001) увеличивает AUC под кривой «концентрация уридина-время» при использовании всех дозировок вещества (рис.3), однако увеличение дозы с 2000 мг до 4000 мг не сопровождается дальнейшим ростом данного показателя. Пик концентрации уридина отмечается через 1,5 часа после дозы 500 мг, и через 3 часа – после других доз, составляя 101, 136 и 134% от базовых значений соответственно возрастающей дозе. Повышение сохраняется 5–6 часов при всех дозировках. И если прием пищи (обед) несколько замедляет спад концентраций холина (рис.2), то на динамику концентраций уридина он не влияет. Циркулирующие в крови метаболиты цитиколина в значительной степени распределяется в структурах головного мозга, с быстрым внедрением фракций холина в структурные фосфолипиды. Уридин, после проникновения через ГЭБ, превращается в уридин-5’-трифосфат, который в дальнейшем может метаболизировать до цитидин-трифосфата и CDP-холина. Только 15 % введенной дозы цитиколина выводится из организма человека; менее 3 % — почками и около 12 % — с выдыхаемым СО2. Менее 1% цитиколина выделяется с фекалиями.
Таким образом, исходя из фармакокинетики цитиколина, для создания относительно равномерной эффективной концентрации вещества и его метаболитов в плазме крови необходимо применение внутрь в дозе 500 мг 3 раза в день, или 2000 мг 2 раза в день. Повышение дозировки нецелесообразно из-за отсутствия дополнительного прироста концентрации активных метаболитов (холина и уридина) в крови.
Фармакодинамика цитиколина
Влияние цитиколина на нейромедиаторные процессы в мозге
Ряд исследований показал, что пищевые добавки цитиколина увеличивают содержание в мозге холин-содержащих веществ, повышающих биоэнергетику. Так, S.M.Babb и соавторы (1996), применив метод протонной магниторезонансной спектроскопии (MRS) in-vivo, выявили, что однократная доза CDP-холина увеличивает концентрацию холина в плазме крови как у молодых, так и у пожилых лиц через 3 часа после приема. Продолжая это исследование, в более поздней публикации те же авторы (S.M.Babb и соавт., 2002) методом MRS измерили изменения биохимии мозга у здоровых лиц после 6 недель приема 500 мг цитиколина. Они обнаружили повышение в структурах мозга фосфодиэфиров, которое коррелировало с клиническими признаками улучшения памяти. М.М.Silveri и соавторы (2008) с помощью MRS-метода оценили уровни метаболитов мозга у лиц в возрасте 40 – 60 лет, получавших постоянно пищевые добавки цитиколина в течение 6-и недель в дозах 500 или 2000 мг/день. Наблюдалось достоверное повышение уровней фосфокреатина в передней части поясной извилины коры головного мозга, что подтверждает предположение об улучшении биоэнергетики и поддержании функции фосфолипидов клеточных мембран мозга во фронтальной коре. Результаты исследований на животных оказались комплементарны данным, полученным в исследованиях у человека, и подтвердили потенциальную роль цитиколина в регуляции нейротрансмиттерных процессов мозга: 28-дневное введение крысам цитиколина увеличивало высвобождение дофамина в стриатуме (J.Agut и соавт., 2000).
Влияние цитиколина на показатели умственной деятельности
Необходимо подчеркнуть, что большинство работ по оценке влияния цитиколина на когнитивные функции выполнено у лиц старше 40 лет, в основном у пожилых. В этой возрастной группе получены достоверные данные об улучшении внимания, памяти, времени реакции и других показателей (A.Agnoli и соавт., 1989; A.Davalos, J.Secades, 2011; Е.McGlade и соавт., 2012). Были установлены параметры курсового применения цитиколина в этой возрастной группе (включая, в первую очередь, лиц с перенесенными инсультами) – 500-2000 мг в сутки в течение 6-и недель с нарастанием эффекта при увеличении дозы. В результате усиливается фокусировка внимания, рабочая память и точность выполнения поставленных задач как у здоровых лиц старше 40 лет, так и у лиц пожилого возраста с нейрокогнитивными нарушениями. Причинами положительного действия цитиколина на сегодняшний день считаются усиление допаминергической передачи (повышение уровня допамина в мозге, чувствительности допаминовых рецепторов) и возмещение нейромедиаторной недостаточности в мозге. Наиболее полная оценка влияния цитиколина на когнитивные функции людей с различными нарушениями мозговой деятельности дана в систематическом обзоре N. Cano-Cuenca и соавторов (2015). В ней сделан достаточно важный для потенциального применения цитиколина в медицине вывод: достоверно доказана эффективность цитиколина в улучшении когнитивных функций у лиц, перенесших острый инсульт, но для вывода о влиянии на возрастные заболевания (болезнь Альцгеймера или васкулярная деменция) нужны дополнительные исследования.
На сегодняшний день нет экспериментальных и клинических подтверждений способности цитиколина в диапазоне терапевтических доз улучшать когнитивные функции у молодых здоровых лиц без признаков нарушения функционального состояния мозга, которые бы служили основанием для применения в составе НМП спортсменов.
Влияние цитиколина на функции поврежденного мозга и устойчивость мозга к повреждениям
С точки зрения практики спортивной медицины нейропротективное действие препарата или БАДа оценивается по его способности: а) снижать реакцию мозга на потенциально опасное травматическое воздействие (проявляется при превентивном, профилактическом назначении вещества) и, тем самым, минимизировать последствия; б) ускорять восстановление после перенесенной черепно-мозговой травмы. Обе эти ситуации имеют место в контактных видах спорта (и не только), а последствия хорошо известны и часто укорачивают продолжительность жизни и снижают ее качество у спортсменов. На протяжении многих лет цитиколин считался одним из наиболее перспективных веществ в комплексном лечении последствий черепно-мозговой травмы (ЧМТ). До 2009 года выполнен целый ряд экспериментальных исследований эффектов цитиколина при ЧМТ. Установлено, что цитиколин оказывает нейропротективное действие (С.Е.Dixon и соавт., 1997; М.К.Baskaya и соавт., 2000; R.J.Dempsey, V.L.Raghavendra Rao, 2003): достоверно предотвращает потерю нейронов в гиппокампе, вызванную ЧМТ, снижает величину контузии коры головного мозга и улучшает неврологическое восстановление. Кроме того, цитиколин дозо-зависимо снижает хронический моторный и пространственный дефицит, увеличивает внеклеточный уровень ацетилхолина – ключевого медиатора процессов памяти (C.E.Dixon и соавт., 1997). Эти факты свидетельствуют в пользу способности цитиколина усиливать холинергическую передачу и ликвидировать хронический функциональный дефицит при ЧМТ. Другой фактор действия цитиколина – ослабление процесса падения уровня допамина, развивающегося после травмы (B.M.Ross и соавт., 2001; R.Rejdak и соавт., 2002; J.J.Secades, G.Frontera, 1995), что способствует восстановлению. Рандомизированные клинические исследования цитиколина при ЧМТ показали ускорение функционального восстановления при наличии фокального моторного дефицита у пациентов с сильной ЧМТ (F.Cohadon и соавт., 1982), восстановление воспоминаний, объема памяти (H.S.Levin, 1991), снижение пост-контузионной симптоматики при ЧМТ слабой выраженности, снижение времени пребывания в больнице и потребности в повторной госпитализации (V.Calatayud Maldonado и соавт., 1991). Цитиколин также усиливал мозговой кровоток: после введения вещества пациентам с ЧМТ и выраженной потерей памяти устранялась гипоперфузия нижней левой височной области коры головного мозга (J.Leon-Carrion и соавт., 2000).
Однако, выполненное в 2009 году крупное рандомизированное двойное-слепое плацебо-контролируемое мультицентровое исследование эффектов 90-дневного применения цитиколина («COBRIT», R.Zafonte и соавторы, 2009, 2012) в отношении функционального состояния пациентов после ЧМТ разной величины (слабая, средняя, сильная) поставило под сомнение целесообразность использования цитиколина после ЧМТ. Авторами этой большой работы было сделано заключение, что эффективность цитиколина у пациентов с ЧМТ в остром и пост-остром периоде при 90-дневном применении не превышает действия плацебо.
Опровержение данного заключения было сделано сразу в двух не менее серьезных работах: R.M.Adibhata (2013) и J.J. Secades (2014). J.J. Secades (2014) выполнил т.н. кумулятивный мета-анализ на основе работ, опубликованных на протяжении последних 35 лет и имеющихся в базах данных Medline, Embase и Ferrer (последняя компания осуществляет маркетинг цитиколина в ряде стран), которые касались сравнительных исследований цитиколина в острой фазе повреждения мозга. В таблице 2 приведены сведения по таким отобранным работам с указанием тяжести повреждения мозга и схем применения цитиколина.
Таблица 2. Характеристика исследований, включенных в мета-анализ влияния цитиколина на острое повреждение мозга (J.J.Secades, 2014)
| Автор | n | ВПМ | Дозировки |
|---|---|---|---|
| Misbach 1978 | 80 | СР-СИ | 300 мг в/в 14 дней |
| Espagno 1979 | 46 | СИ | 250 мг в/в или в/м 20 дней |
| Richer 1980 | 60 | СИ | 750 мг в/в или в/м 20 дней |
| Cohadon 1982 | 60 | СИ | 750 мг в/в или в/м 20 дней |
| Lecuire 1982 | 25 | СР-СИ | 750 мг в/в 10 дней |
| Lecuire 1985 | 40 | СР-СИ | 750 мг в/в 10 дней |
| Ogashiwa 1985 | 101 | СИ | 1000 мг в/в 7 дней |
| Raggueneau 1988 | 921 | СИ | 500-750 мг в/в 20 дней |
| Calatayud 1991 | 216 | СР-СИ | 3-4 г в/в 4 дня 2 г п/о 26 дней |
| Lozano 1991 | 78 | СР-СИ | 3-6 г в/в 14 дней |
| Aniruddha 2009 | 62 | СЛ | 1 г п/о 30 дней |
| Zafonte 2012 | 1070 | СЛс, СР-СИ | 2 г п/о 90 дней |
Примечания: ВПМ – выраженность повреждения мозга: СЛ – слабое; СЛс – слабое с осложнениями; СР – средней тяжести; СИ – сильное. n – число участников исследования; в/в – внутривено; в/м – внутримышечно; п/о – перорально (внутрь)
Полученные в результате мета-анализа данные четко показывают положительные свойства цитиколина в отношении ЧМТ и, в отличие от исследования COBRIT, сфокусированы именно на цитиколине (при таком подходе действие цитиколина не «растворено» в эффектах других компонентов комплексного лечения ЧМТ, как в COBRIT).
Таким образом, положительное действие цитиколина обусловлено, в первую очередь, ускорением восстановления мозговых функций после травматических повреждений, сокращением сроков реабилитации, более полной реставрацией памяти и способности к обучению, речевой и двигательной активности. Это имеет и фармако-экономический эффект – снижение затрат на восстановительные процедуры и возвращение к тренировочной и соревновательной практике. В настоящее время цитиколин дистрибьютируется в 60 странах мира по ряду показаний, среди которых ЧМТ и ее последствия.
Полученные результаты открывают дорогу сразу для двух направлений применения цитиколина: 1) в клинической медицине – для лечения последствий спортивной ЧМТ разной степени тяжести (к спортивной нутрициологии не относится, и является чисто клинической задачей) и 2) превентивного курсового применения цитиколина как БАДа с нейропротективным действием в контактных видах спорта в составе комплексной НМП для повышения устойчивости мозга к постоянным (хроническим) травмирующим воздействиям и снижения последствий такой хронической травматизации.
Второе направление соответствует задачам спортивной нутрициологии, т.к. подразумевает составление таких схем НМП, где стрессо-устойчивость мозговой ткани формируется последовательно на протяжении месяцев целенаправленных пищевых интервенций.
Потенциальные возможности превентивного применения цитиколина в контактных видах спорта. Целый ряд фармакодинамических свойств цитиколина, в первую очередь нейропротективное действие при профилактическом назначении, заставляют специалистов в области спортивной медицины рассматривать это вещество как перспективный компонент в составе спортивного питания в таких контактных видах спорта, как бокс, борьба, другие виды единоборств, футбол, хоккей. В этих специальных дисциплинах микроповреждения головного мозга в результате сотрясений и ударов, постепенно (или однократно) накапливаясь, могут приводить к серьезным ближайшим или отдаленным нарушениям высшей нервной деятельности. Повышение устойчивости к травмирующим мозг внешним воздействиям, предотвращение развития хронической травматической энцефалопатии (ХТЭ) – важная задача спортивного врача.
Хроническая травматическая энцефалопатия (ХТЭ) в спорте
Несмотря на то, что впервые термин ХТЭ (Chronic Traumatic Encephalopathy — CTE) появился в медицинской литературе в 1960-х годах прошлого столетия применительно к категории спортсменов-боксеров, проблема остается актуальной и трудно решаемой и в наше время и в других видах спорта (А.С.McKee и соавт., 2009; B.I.Omalu и соавт., 2005, 2006). ХТЭ – нейродегенеративное заболевание, причиной которого, по крайней мере частично, являются повторяющиеся травмы мозга, включающие как сильные, так и слабые воздействия. Последствиями таких многократно повторяющихся повреждений мозга являются: нарушение исполнительных функций; снижение памяти; депрессия и суицидальные настроения; апатия; слабый контроль импульсивных реакций и, в конечном счете, деменция. Ранние симптомы ХТЭ у спортсменов приведены в таблице 3.
Таблица 3. Ранние симптомы ХТЭ у спортсменов в контактных видах спорта (С.М. Baugh и соавт., 2012)
| Категория | Симптомы |
|---|---|
| Когнитивные | Нарушение памяти. Дисфункция процессов организации и оценки тренировочных задач (проблемы с планированием, постановкой задач и последовательностью их исполнения, критической оценкой результатов и четкостью суждений) |
| Изменение настроения | Депрессия, апатия, раздражительность, суицидальные мысли |
| Поведенческие | Проблемы с импульсивным контролем (например, быть вспыльчивым, легко выходить из себя, «заводиться с пол-оборота»). Снятие тормозных ограничений. Злоупотребление алкоголем и/или наркотиками, а также другие виды зависимости. Агрессия, склонность к насильственным действиям. |
Достаточно детальный анализ этиологии и патогенеза ХТЭ у боксеров сделано в работе Н.Е. Полищук и А.В. Муравского (2009). В этом обзоре дана эпидемиология ЧМТ, механизмы развития повреждений, патанатомия и патофизиология ХТЭ, клинические и неврологические симптомы, критерии оценки степени нарушений и постановка диагноза, тестирование спортсменов. Однако в небольшом разделе «Профилактика травматической энцефалопатии боксеров» рекомендации сводятся к выявлению групп риска. Применение нейропротекторов и антиоксидантов в лечении и предупреждении ХТЭ обозначено в качестве пожеланий для дальнейшего изучения без какой-либо детализации, что свидетельствует об отсутствии данных такого рода в отечественной литературе.
Поскольку получение хронических травмирующих мозг воздействий во многих видах контактного спорта является неизбежным, встает вопрос профилактики с целью смягчения реакции на макро- и микроповреждения и минимизации их последствий. Определенную роль может играть включение в состав комплексной НМП нейропротекторных средств природного происхождения. Частичным подтверждением этого положения могут служить данные о компенсаторном повышении содержания холина у атлетов, имеющих в анамнезе повторяющиеся травмы мозга, по сравнению со спортсменами аналогичного возраста без истории получения таких травм (A.Lin и соавт., 2010). Защитное действие цитиколина при превентивном применении также может быть обусловлено повышением уровня глутатиона в мозге (R.M.Adibhatla и соавт., 2001; М.Barrachina и соавт., 2003; J.P.De la Cruz и соавт., 2000), обладающего мощным антиоксидантным эффектом. Кроме того, цитиколин может снижать апоптоз и предотвращать клеточную смерть в эксперименте (J.Krupinski и соавт., 2002; C.Mir и соавт., 2003), что, по мнению J.Erdman и соавторов (2011) в совокупности может служить основанием для рутинного применения пищевых добавок цитиколина в составе НМП при повторяющихся травмах головного мозга.
Хотя на сегодняшний день и недостаточно данных для отнесения цитиколина и других производных холина к спортивным добавкам категории «А» (высшая степень доказательности), тем не менее они входят в качестве перспективных БАДов во многие классификации (S. Potgieter, 2013; M.H.Williams, 2004), и могут, с нашей точки зрения, быть отнесены по уровню доказательности к категории «В» Учитывая высокий профиль безопасности цитиколина, и высокую научную обоснованность его использования в качестве нейропротектора, в практической работе целесообразно курсовое назначение цитиколина спортсменам в контактных видах спорта в дозах 500-1000 мг 2 раза в день в течение 4-8 недель с перерывами 1-1,5 месяца.
Комментариев нет:
Отправить комментарий