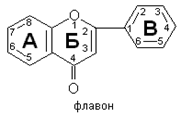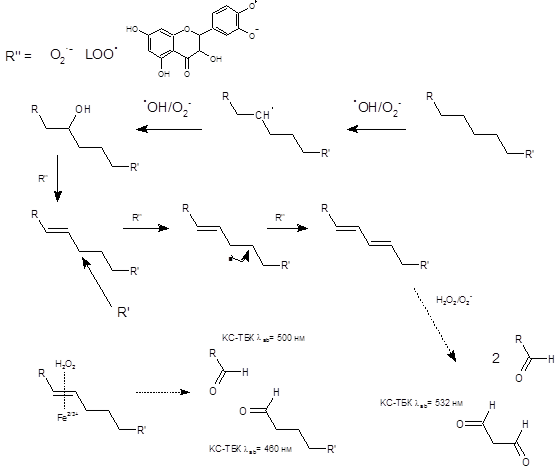Содержание
| АДФ | – | аденозин-5'-дифосфат |
| АК | – | аскорбиновая кислота |
| АКМ | – | активные кислородные метаболиты |
| цАМФ | – | аденозин-3',5'-циклофосфат |
| АОА | – | антиоксидантная активность |
| АРА | – | антирадикальная активность |
| АТФ | – | аденозин-5'-трифосфат |
| АФК | – | активные формы кислорода |
| БТШ | – | белки теплового шока |
| БХС | – | биохимическая система |
| цГМФ | – | гуанозин-3',5'-циклофосфат |
| ДГК | – | дигидрокверцетин |
| ДК | – | диеновые коньюгаты |
| ДНК | – | дезоксирибонуклеиновая кислота |
| МДА | – | малоновый диальдегид |
| МК | – | мочевая кислота |
| НАДН | – | никотинамидадениндинуклеотид, восстановленная форма |
| ПОЛ | – | перекисное окисление липидов |
| РНК | – | рибонуклеиновая кислота |
| РФК | – | радикальные формы кислорода |
| СОХ | – | циклооксигеназа |
| ТБК | – | тиобарбитуровая кислота |
| ФМА | – | форбол-12-меристат-13-ацетат |
| ФС | – | фагоцитсодержащая система |
| ФТШ | – | фактор теплового шока |
| ХЛ | – | хемилюминесценция |
Флавоноиды являются одним из классов растительных полифенолов, обладающих широким спектром биологического действия. По одной из гипотез [18], флавоноиды выполняют в растениях роль защитных агентов при различных стрессах, участвуют в предотвращении образования нестабильных радикалов при воздействии УФ-излучения и температурного стресса. В организме животных флавоноиды не образуются и поступают с пищей, где флавоноиды частично претерпевают ряд изменений и выводятся из организма в виде различных метаболитов, преимущественно фенольных кислот, и по большей части в неизменном виде. В попытке объяснить столь широкое действие флавоноидов были предложены несколько гипотез, основывающихся на их антиоксидантной и металлсвязывающей способности. Объяснение широкого спектра биологического действия флавоноидов, как результата высокой антиоксидантной активности этого класса соединений, в некоторой степени объясняет наличие у флавоноидов способности снижать риск развития спонтанных опухолей, их противовоспалительную активность, снижение риска возникновения сердечнососудистых заболеваний при употреблении в пищу продуктов богатых полифенолами [24, 32, 75].
Другой возможный антиоксидантный механизм связан с их хеллатирующими металл свойствами с помощью фенольных ОH групп. Металлы с переменной валентностью часто вовлекаются в генерацию свободных радикалов посредством разложения пероксида водорода и гидропероксидов липида (LOOH), с образованием гидроксильного или алкоксильного радикала, соответственно [14]. Флавоноид, хеллатируя металл, может изолировать эти ионы и, таким образом, предотвратить формирование свободных радикалов.
С другой стороны группой ученых под руководством Наруми Сугихара [72] было продемонстрировано наличие прооксидантного действия флавоноидов на модели окислительного повреждения гепатоцитов индуцированного гидропероксидами. Этой группой ученых были проанализированы про/антиоксидантные свойства мирицетина, кверцетина, фисетина, кэмпферола, морина, лютеолина, апигенина и таксифолина (дигидрокверцетина). Необходимо отметить, что в этих работах, для таксифолина было обнаружено наличие как анти- , так и прооксидантной активности в зависимости от концентраций Fe2+ , но с другими металлами таксифолин проявлял только антиоксидантные свойства. Сходные работы по изучению поведения флавоноидов в присутствие металлов переменной валентностью были выполнены группами Костюка В.А. [45] и Афанасьева И. Б. [1]. В их работах внимание было сосредоточено на изучении комплекса рутина и меди, проявляющего высокую антиоксидантную и гепатопротекторную активность в сравнении со свободным флавоноидом. Благодаря этим работам можно предположить, что в связанном с металлом состоянии флавоноид обладает несколько иными окислительно-восстановительными свойствами. Таким образом, изучение про-антокисидантных свойств комплексов флавоноидов с переходными металлами позволит определить возможность участия полифенолов в индукции окислительного стресса и определить условия возникновения у флавоноидов прооксидантных свойств.
Целью данной работы было определение условий проявления дигидрокверцетином и его комплексов с металлами про- и антиоксидантных свойств.
В связи с чем были поставлены следующие задачи:
1. Определение антиоксидантных свойств дигидрокверцетина и его способность ингибировать перекисное окисление липидов.
2. Определение условий, при которых флавоноид и его комплекс с металлом переменной валентности проявляет про- и антиоксидантные свойства.
ГЛАВА I. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1.1 Классификация флавоноидов
Флавоноиды представляют собой широкий класс природных полифенольных соединений, структурно содержащих 2 ароматических кольца соединенных через пирановый или пироновый цикл (рис. 1). Структура большинства флавоноидов соответствует структуре ядра токоферолов, но в отличие от последнего содержит не изопреноидную цепь, а фенольный фрагмент, определяющих в большинстве случаев его антиоксидантные свойства. Начало активного исследования биологической активности флавоноидов начинается с 1936 г с работы венгерского биохимика Сент-Дьёрдьи, выделавшего в чистом виде витамин Р (рутин). Позднее было показано, что помимо капилляроукрепляющего действия флавноноиды (кверцетин, рутин, гесперитин и др.) проявляли и другие виды биологических активностей [Меньшикова Е.Б., и др., 2006].
Рис.1 Структурная формула флавонов.
Флавоноиды, как большинство фенольных соединений, синтезируются в растениях по двум общим механизмам: шикиматному и ацетатно-малонатному (поликетидному) путям. Шикиматный путь (рис.2) объединяет в себе биосинтез ароматических аминокислот, включая L-фенилаланин, и начальные этапы биосинтеза фенольных соединений.
Рис.2 Шикиматный путь биосинтеза флавоноидов.
Флавоноиды широко распространены в растительном мире. Особенно богаты флавоноидами высшие растения, относящиеся к семействам розоцветных (различные виды боярышников, черноплодная рябина), бобовых (софора японская, стальник полевой, солодка), гречишных (различные виды горцев - перечный, почечуйный, птичий: гречиха), астровых (бессмертник песчаный, сушеница топяная, пижма), яснотковых (пустырник сердечный) и др. Более часто флавоноиды встречаются в тропических и альпийских растениях. Обнаружены и у низших растений: зеленые водоросли (ряски), споровые (мхи, папоротники), хвощи (хвощ полевой), а также у некоторых насекомых (мраморно-белая бабочка) . Находятся флавоноиды в различных органах, но чаще в надземных: цветках, листьях, плодах; значительно меньше их в стеблях и подземных органах (солодка, шлемник байкальский, стальник полевой). Наиболее богаты ими молодые цветки, незрелые плоды. Локализуются в клеточном соке в растворенном виде. Содержание флавоноидов в растениях различно (Таблица 1): в среднем 0,5-5%, иногда достигает 20% (в цветках софоры японской). В растениях флавоноиды встречаются в виде гликозидов и в свободном виде. Во многих фруктах и ягодах биофлавоноиды более или менее равномерно распределены в кожице и мякоти. Поэтому слива, вишня, черника имеют ровную окраску. В противоположность этому, в плодах некоторых других растений флавоноиды содержатся, в основном, в кожице, и, в меньшей степени, - в мякоти. А в яблоках, например, они имеются только в кожице.
Таблица 1. Содержание флавоноидов в растениях.
| Кемпфе- рол | Кверце-тин | Кемп-ферол | Кверце-тин |
| Яблоки | 0-7 | 20-263 | Чёрный виноград | 0-2 | 15 |
| Айва | 0 | 63 | Белый виноград | 0-2 | 12 |
| Абрикосы | 0-2 | 25-53 | Огородная капуста | 210-250 | 50-110 |
| Груши | 0-12 | 3-28 | Краснокочанная капуста | 0-2 | 5-6 |
| Кислая вишня | 5-17 | 23-80 | Белокочанная капуста | 0-2 | 0-1 |
| Сладкая вишня | 0-6 | 6-24 | Цветная капуста | 0-2 | 0-1 |
| Слива | 0-2 | 0-15 | Лук-порей | 30-200 | 0-25 |
| Персики | 0-2 | 0-4 | Лук-резанец | 10 | 300 |
| Бузина | 0 | 105-237 | Лук репчатый (цветной) | 0-2 | 347 |
| Черника | 0-6 | 105-160 | Цикорий | 46 | 1-2 |
| Чёрная смородина | 0-10 | 33-68 | Французская фасоль | 12 | 39 |
| Белая смородина | 0-2 | 3-28 | Стручковая фасоль | 0-2 | 29 |
| Красная смородина | 0-2 | 2-27 | Томаты | 0-2 | 7-8 |
| Ежевика | 14 | 33 | Морковь | 0-1 | 0-2 |
| Земляника | 12 | 9 | Картофель | 0-1 | 0-2 |
| Малина | 0-1 | 29 |
1.2.1 Роль флавоноидов в растениях
Биологическая роль флавоноидов заключается в их участии в окислительно-восстановительных процессах, происходящих в растениях. Они выполняют защитные функции, предохраняя растения от различных неблагоприятных воздействий окружающей среды. Многие флавоноиды — пигменты, придающие разнообразную окраску растительным тканям. Так, антоцианы определяют красную, синюю, фиолетовую окраску цветов, а флавоны, флавонолы, ауроны, халконы — жёлтую и оранжевую. Они принимают участие в фотосинтезе, образовании лигнина и суберина, в качестве защитных агентов в патогенезе растений, вовлечены в регуляцию процессов прорастания семян, а также пролиферации и отмирания (путем апоптоза) клеток удлиняющихся растущих частей растений. Их многообразие объясняется тем, что в растениях большинство из них присутствует в виде соединений с сахарами — гликозидов. Сахарные остатки могут быть представлены моносахаридами — глюкозой, галактозой, ксилозой и др., а также различными ди-, три- и тетрасахаридами. К сахарным остаткам нередко присоединены молекулы оксикоричных и оксибензойных кислот.
Катехины и лейкоантоцианы бесцветны. Они являются родоначальниками конденсированных дубильных веществ.
Под влиянием ферментов флавоноиды расщепляются на сахара и агликоны. В качестве cахаров встречаются D-глюкоза, D-галактоза, D-ксилоза, LT-рамноза и LT-арабиноза, D-глюкуровая кислота.
Естественные функции флавоноидов мало изучены. Предполагалось, что благодаря способности поглощать ультрафиолетовое излучение (330—350 нм) и часть видимого света (520—560 нм) они защищают растительные ткани от избыточной радиации. Окраска цветочных лепестков помогает насекомым находить нужные растения и тем самым способствовать опылению. Флавоноиды являются фактором устойчивости растений к поражению некоторыми патогенными грибами.
Суммарное содержание флавоноидов изменяется в ряду различных местообитаний; на накопление флавоноидных соединений влияние оказывают такие факторы, как степень освещенности и обеспеченности элементами минерального питания, фитоценотическое окружение [82].
1.2.2 Метаболизм флавоноидов в организме животных
Всасывание этих соединений в желудочно-кишечном тракте варьирует в зависимости от их структуры и может изменяться в широких пределах (по некоторым данным от 4% до 60%). В растительном сырье и пищевых продуктах флавоноиды находятся в основном в форме гликозидов, а не агликонов. Данные по их адсорбции в кишечнике неоднозначны, и долгое время считалось, что флавоноиды могут всасываться только в форме агликонов. Однако, недавно было установлено, что в случае кверцетина именно гликозидные формы характеризуются высокой всасываемостью.
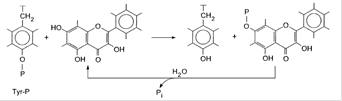
Основными системами метаболизма флавоноидов являются ферментативные системы печени и кишечной микрофлоры, однако и другие ткани, в частности, стенки тонкого кишечника и почки, по–видимому, тоже могут участвовать в этих процессах. Поступившие в печень флавоноиды подвергаются глюкуронидной и сульфатной коньюгации с образованием глюкуронидов и эфиров серной кислоты, а в ряде случаев и О–метилированию (рис.3). Невсосавшиеся флавоноиды подвергаются в кишечнике биодеградации под действием кишечной микрофлоры. Основные процессы на этом этапе — гидролитическое расщепление гликозидов и коньюгатов, а также деструкция бензольных ядер в агликонах с образованием в качестве метаболитов различных гидрокси– и метоксипроизводных ароматических кислот — фенилпропионовой и коричной, которые экскретируются с мочой. По–видимому, с мочой выводятся и коньюгаты флавоноидов.
Флавоноиды обладают капилляроукрепляющим, противовоспалительным, антиаллергическим, антибактериальным и противовирусным эффектами. Они оказывают спазмолитическое действие, в том числе на сосуды сердца и головного мозга, положительно влияют на обменные процессы в миокарде, обладают антиаритмическим действием, тормозят агрегацию тромбоцитов и их адгезию к эпителию сосудистой стенки, нормализуют реологию крови, проявляют антиатеросклеротическое и антигипертензивное, противоязвенное и гепатопротекторное действие. Известны флавоноиды, регулирующие гормональный баланс организма, влияя на уровень кортикоидных гормонов и катехоламинов и проявляя эстрогеноподобную активность (это характерно прежде всего для семейства изофлавоноидов — фитоэстрогенов) (Медисоя, Артемида). Ряд флавоноидов обладает антимутагенным и антиканцерогенным действием. Соединения этого класса влияют на состояние иммунной системы, модулируя функцию ее различных звеньев. Столь широкий спектр фармакологической активности флавоноидов определяется их регулирующим и модулирующим действием на ключевые функциональные системы клеток, органов и тканей организма, что проявляется как в локальном, так и в системном ответах организма.
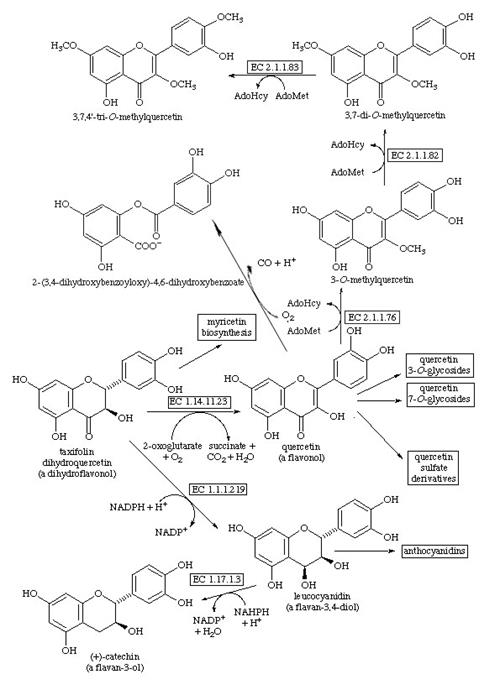
Рис.3 Метаболизм дигидроквертецина.
1.3 БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ФЛАВОНОИДОВ
1.3.1 Антиоксидантная активность флавоноидов
Одно из более известных свойств флавоноидов – это их превосходная антирадикальная активность, что и используется при снижении действия АФК при инфекциях, воспалении, ожогах или лучевом поражении.
Реакция флавоноидов с АФК характеризуется высокими скоростями, составляющими для OH-радикала – 5х108М-1 с-1 , для перокисного радикала липидов – 0,18х108 М-1 с-1 (кверцетин), несколько ниже для супероксид аниона – 4х104 М-1 с-1 (катехин).
Флавоноиды легко и необратимо окисляются до п-гидрохиноновой формы, которая далее обратимо может окисляться до п-хинона. Последний легко полимеризуется в не растворимое соединение. Окисление флавоноидов катализируется ионами тяжелых металлов и под действием света. Промежуточные формы окисления флавноидов могут являться токсичными для клеток, а в процессе их взаимопревращения в ряде случаев образуются АФК (рис. 4).
Рис.4 Окислительно-восстановительные превращения кверцетина ( Metodiewa D , et . al ., 1999; Меньшикова Е.Б., и др., 2006).
Тем не менее, флавоноиды считают одними из наиболее значимых антиоксидантов, антиоксидантная активность которых возрастает в присутствии аскорбиновой кислоты. Другой причиной высокой антиоксидантной активностифлавоноидов, может быть их ингибирующая активность ряда ферментов, включая гидролазы, например фосфолипазы, оксидоредуктазы, например избирательно ингибируют COX1 или COX2, связанные с воспалительным и репарационным ответами соответственно, ДНК-синтетазы, РНК-полимеразы, фосфатазы, фосфокиназы, оксигеназы, и оксидазы аминокислот. В некоторых случаях, тип ингибирования конкурентный, но чаще это аллостерическое ингибирование. Многие флавоноиды также способны ингибировать цАМФ и цГМФ фосфодиестеразы, в результате чего увеличивается уровень цАМФ, участвующего в различных каскадах. Многочисленные экспериментальные исследования в водных системах позволили выявить следующие наиболее важные для антирадикальной активности структурные элементы молекул флавоноидов: 1) две ОН-группы в положениях СЗ' и С4', 2) двойная связь между 2 и 3 атомами углерода, желательно совместно с карбонильной группой в положении С4 и 3) ОН-группы в положениях СЗ и С5 совместно с карбонильной группой [10].
В молекулах флавоноидов ОН-группа в положении С4' представляет собой наиболее предпочтительную мишень для радикальной атаки, при этом наличие ОН-групп у соседнего атома углерода СЗ' (катехоловая структура) или СЗ' и С5' (галловая структура) облегчает отрыв атома водорода. Между соседними гидроксилами кольца В образуются водородные связи, поэтому соединения, имеющие такие структуры, характеризуются низким окислительным потенциалом и относительно легко образуют радикалы [19, 76]. Кроме того, присутствие opтo-дигидроксильной структуры приводит к большей делокализации неспаренного электрона и повышает стабильность феноксилыюго радикала [10]. Синтезированные на структурной основе флавона соединения, не содержащие ОН-групп в В-кольце, не проявляли существенной антиоксидантной активности в отношении окисления липидных липосом при индукции ионами Fe2+, Fe3+ и 2,2'-азобис(2-амидинопропан)дигидрохлоридом [5]. Катехоловые структуры также эффективно связывают ионы металлов переменной валентности, препятствуя тем самым их вовлечению в реакции разложения гидроперекисей. Прежде всего это касается катехоловых структур В-кольца, однако при Fe +- и Ре3+-индуцированном окислении, так же, как в отношении ОН-радикалов в реакции Фентона и пероксинитрита, выраженный ингибирующий эффект дают соединения, содержащие ОН-группы в положениях С7 и С8 или С5 и С6 [5, 17, 40]. Замена ОН-групп в положениях С5, С7 или СЗ на O-D-глюкозу приводила к снижению способности флавоноидов ингибировать перекисные и ОН-радикалы, а также ONOO- [40].
Важность двойной связи С2-СЗ для антиоксидантного действия флавоноидов, повидимому, определяется образованием диеновой структуры между атомом кислорода в положении С4 и электронной структурой В-кольца, что приводит к делокализации элек¬тронной плотности по всей молекуле при образовании радикала. Действительно, экспе¬риментальное исследование показало несколько большее смещение в область С-кольца спиновой плотности неспаренного электрона в радикале кверцетина, имеющем ненасыщенную связь С2-СЗ, по сравнению с аналогичным по структуре радикалом таксифолина, у которого эта связь одинарна. Кроме того, наличие двойной С2-СЗ-связи ограничивает подвижность В-кольца и способствует формированию планарной структуры молекулы, что важно для ингибирования ферментативной продукции АКМ, в частности, в ксантин-ксантиноксидазной реакции [9].
Несмотря на большое количество исследований in vitro и несомненный факт наличия флавоноидов в рационе питания человека и животных, убедительных доказательств доминирующего антиоксидантного действия флавоноидов в каких-либо процессах в организме in vivo нет.
1.3.2 Металлсвязывающая способность флавоноидов
Флавоноиды также могут действовать как хелаторы ионов металла с радикалами О- и ОН*, так и на стадии продолжения цепи, выступая донорами атомов водорода для перекисных радикалов. Многие флавоноиды действуют как хелаторы ионов металлов переменной валентности и способны, таким образом, ингибировать процессы ПОЛ на стадии разветвления цепей, когда ионы металлов индуцируют гомолиз органических перекисей. Для связывания ионов металлов важно наличие в молекулах дигидроксильной структуры в В-кольце (предпочтительна катехоловая структура с ОН-группами в СЗ'- и С4'-положениях), а также кетогруппы в положении С4 совместно с СЗ- или С5-гидроксилом [12, 16, 60]. Такие структуры имеют молекулы флавонолов (мирицетин, кверцетин, рутин и др.), флавонов (гиполактин, лютеолин, ориентин и др.), дигидрофлавонолов (таксифолин, фустин), поэтому хелатирование ионов металлов переменной валентности представляет собой важный механизм антиоксидантного действия в биологических системах природных флавоноидов, обычно представленных в виде сложной композиции разных классов молекул. Окисление линоленовой кислоты, индуцированное ионами Fe2+совместно с Н2 02 , ингибировалось рутином и кверцетином в большей степени за счёт связывания ионов железа, нежели в результате ингибирования радикалов [22].
1.3.3 Прооксидантные свойства флавоноидов
Наряду с антиоксидантными свойствами, флавоноиды способны проявлять прооксидантный эффект. Этому способствует способность флавонойдов окисляться – восстанавливаться, как получая электрон от органических продуктов, так и металлов переменной валентности. Прооксидантные и антиоксидантные свойства флавоноидов во многом зависят от их растворимости, соотношения окислителей и восстановителей в среде, наличия металлов переменной валентности, рН среды и многих других факторов [21]. Если в присутствии органических перекисей флавоноиды подавляют индуцированное Сu2+ окисление липопротеинов, то в отсутствие перекиси водорода они проявляют себя преимущественно как прооксиданты и усиливают окисление; при этом прооксидантная активность флавоноидов так же, как в случае ингибирования ОН-радикалов и перекисных радикалов, прямо зависит от наличия ОН-заместителей и двойной связи С2-СЗ между кольцами А и В [13].
Во многих исследованиях in vitro у флавоноидов выявляется как антиоксидантный, так и прооксидантный эффект, особенно в присутствии ионов металлов переменной валентности. Так, морин и нарингенин индуцировали окисление липидов в изолированных ядрах из печени крыс, а также вызывали образование сшивок в ДНК [63]. Присутствие ионов железа и меди усугубляло прооксидантные свойства флавоноидов; каталаза, СОД и маннитол не влияли на повреждение ДНК. Усиление флавоноидами (кверцетин, мирицетин, кемпферол) окислительного повреждения ДНК в изолированных ядрах печени крыс может быть связано со снижением содержания в ядрах глутатиона и глутатин-S-трансферазы [64]. Несмотря на высокую антиоксидантную активность, кверцетин индуцирует повреждение ДНК и обладает мутагенной активностью [51]; в концентрациях выше 100 мкМ он оказывал токсический эффект на клетки СНО, который зависел от DT-диафоразной активности в клетках [53]. Имеющие галловую структуру флавонолы (мирицетин и кверцетагетин) могут аутоокисляться в митохондриях с образованием О2 и Н2 О2 [34]. Прооксидантный и мутагенный эффекты кверцетина могут быть связаны с продукцией других радикалов, образующихся при его окислительно-восстановительных преобразованиях.
Флавоноиды ингибируют процессы ПОЛ как на стадии инициации, взаимодействуя с радикалами О- и ОН*, так и на стадии продолжения цепи, выступая донорами атомов водорода для перекисных радикалов. Образующиеся при этом радикалы флавоноидов активно вступают в реакции диспропорционирования с другими радикалами (таблица 2). Флавоноиды (за исключением флавонов и флаванонов) эффективно ингибировали супероксидные анион-радикалы, возникающие при взаимодействии Н2 02 с ацетоном в щелочной среде, для антирадикальной активности важным было присутствие гидроксильных групп в В-кольце и положении СЗ, при этом агликоны были более эффективны, чем гликозилированные формы [69].
Структурный анализ и экспериментальные данные свидетельствуют о прямой взаимосвязи между антиоксидантной эффективностью флавоноидов и количеством фенольных ОН-групп в их молекулах [5, 43, 50]. Исследование разных по структуре флавоноидов показало, что соединения без ОН-заместителей или с одной гидроксилыгой группой в положении С5 флавонового ядра не проявляют сколько-нибудь значимой активности в отношении перекисных радикалов, возникающих при разложении 2,2'-азобис(2-амидинопропан)дигидрохлорида; эффективность флавонов с одним ОН-заместителем в положениях СЗ, С6, С2', СЗ' или С4' составляла меньше 60 % эффективности тролокса [13].
Таблица 2. Константы ингибирования радикалов флавоноидами и эфирами галловой кислоты [11].
| Число реакционно-способных ОН-групп | Константы скорости ингибирования |
| . ОН (х 109 М-1 с- 1 ) | . N3 (х 109 М-1 с- 1 ) | . O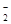 (х 104 М-1 с- 1 ) (х 104 М-1 с- 1 ) |
| (-)Эпикатехин | 2 | 1,0 | 4,0 | 6,8 |
| (+)Катехин | 2 | 2,2 | 5,0 | 6,4 |
| Пикногенол | 2 | 1,8 | 1,75 | 43 |
| (-)Эпигаллокатехин | 3 | 4,7 | 4,7 | 41 |
| (-)Эпикатехина галлат | 5 | 5,8 | 4,7 | 43 |
| (-)Эпигаллокатехина галлат | 6 | 7,1 | 4,8 | 65 |
| Пропилгаллат | 3 | 3,1 | 4,2 | 26 |
| Р-Глюкогаллин | 3 | 4,4 | 6,3 | 65 |
| Пентагаллоил-глюкоза | 15 | 71 | 20 | 103 |
| Галлодубильная кислота (танин) | 25 | 31 | 22 | - |
Таблица 3. Ингибирование основными флавонами и катехинами чая продукции О2 - ксантиноксидазой [6].
| Катехин, флавон | Тип ингибирования | IС50 (мкМ) |
| Катехин | неконкурентное | 303,95 |
| Эпикатехин | смешанное | 20,48 |
| Эпигаллокатехин | смешанное | 10,66 |
| Эпикатехина галлат | смешанное | 2,86 |
| Эпигаллокатехина галлат | конкурентное | 0,76 |
Многие флавоноиды, такие как кверцетин, мирицетин, лютеолин, рамнетин, силибинин, не только обладают антиоксидантной активностью, но и способны ингибировать циклооксигеназы 1 и 2 типа, липоксигеназы и тем самым снижать продукцию провоспалительных медиаторов: лейкотриенов, простагландинов и активных форм кислорода [55, 61, 62]. Супрессивная эффективность флавоноидов в отношении 5-липоксигеназы и циклооксигеназы перитонеальных лейкоцитов крыс коррелировала с их способностью связывать и восстанавливать ионы железа [49].
В сложных системах, таких как индуцированное ионами металлов переменной валентности окисление линоленовой кислоты в гепатоцитах [73], прямой взаимосвязи антиоксидантного действия флавоноидов с определёнными структурными элементами их молекул выявить не удаётся, что объясняется исследователями наличием в молекулах флавоноидов нескольких центров связывания ионов металлов. Исследование на культурах клеток сетчатки эмбрионов цыплят показало, что в отношении Fe2+ -индуцированного окисления в присутствии аскорбата, восстанавливающего ионы железа (III), защитная роль флавоноидов (кверцетин, лютеолин, таксифолин, эриодиктиол) не зависела от наличия двойной связи С2-СЗ (эриодиктиол и таксифолин с насыщенной связью С2-СЗ были более активны, чем кверцетин и лютеолин), также не выявлялось зависимости от наличия гидроксильной группы в СЗ-положении; в наибольшей степени эффективность флавоноидов в данной экспериментальной системе определялась способностью молекул проникать в липидный слой мембран и образовывать водородные связи [3]. Катехин (таблица 3) существенно снижал индуцированную гидроперекисью линолевой кислоты гибель эндотелиальных клеток человека в культуре, в то же время (-) эпикатехин и (-)эпигаллокатехин были малоэффективны [42]. Морин, имеющий ОН-заместители в положениях С2' и С4', в меньших по сравнению с кверцетином и катехи-ном концентрациях подавлял некроз эндотелиальных клеток свиньи, возникающий поддействием ксантин-ксантиноксидазной системы, что, по-видимому, связано с ингибированием им ксантиноксидазы [79]. Байкалеин и байкалин предотвращали гибель клеток нейробластомы человека и снижали образование малонового диальдегида под действием Н2 02 ; не содержащие С6-гидроксильной группы флавоны (вогонин и вогонозид) в данной системе не проявляли защитного эффекта [27].
В гетерофазных системах, таких как клетки или липопротеины, антиоксидантная эффективность флавоноидов во многом определяется их липофильностью и гидрофильностью [3, 15]. В экспериментальной системе окисления рапсового масла при 105 °С мирицетин проявлял значительно более выраженную ингибирующую активность, чем кверцетин, однако в другой модельной системе (окисление липидов мембран эритроцитов) эффективнее был кверцетин, что связывается с его большей липофильностью [15]. Анализ действия разных по структуре флавоноидов на индуцированные ионами железа процессы ПОЛ в выделенных митохондриях также показал, что их активность главным образом зависит от хелаторных и липофильных свойств молекул, при этом метилирование всех ОН-групп в молекуле кверцетина не снижало антиокислительной активности [67]. На модели ишемии/реперфузии изолированного сердца крысы катехин, введённый в перфузат, предотвращал высвобождение ионов железа и снижал повреждение митохондрий [77].
Помимо того, что флавоноиды обладают антирадикалыюй активностью и могут связывать ионы металлов переменной валентности, они аналогично токоферолу и холестерину стабилизируют мембраны и выступают в качестве структурных антиоксидантов. Проникая в гидрофобную область мембран, молекулы флавоноидов значительно снижают подвижность липидов, что в свою очередь, снижает эффективность взаимодействия пероксильных радикалов с новыми липидными молекулами (RО2 * + RH —> ROOH + R*); так как в большинстве биологических мембран данная стадия цепных процессов ПОЛ является лимитирующей, то, соответственно, снижается скорость всего процесса окисления [4].
Показано ингибирование флавоноидами активности самых разных ферментов, таких как липоксигеназа, циклооксигеназа, монооксигеназы, ксантиноксидаза, митохондриальные сукцинатдегидрогеназа и НАДН-оксидаза, фосфолипаза А2 [13, 31], топоизомеразы и всевозможные протеинкиназы: протеинкиназа С, протеин-киназа В (Akt), мембранная и цитозольная тирозинкиназы, фосфатидилинозитол-3-киназа (PI3K), внеклеточнорегулируемая киназа (ERK), казеинкиназа 2 (СК2), АМФ-активируемая протеинкиназа (АМРК), и многие другие [20, 54, 56], при этом подавление активности киназ осуществляется преимущественно по одному общему механизму, путём конкуренции с АТФ за соответствующий участок связывания на ферменте [54].
Синтетические производные флавоноидов, например, флавонуксусная кислота на данный момент уже прошли 1 фазу клинических испытаний, и уже скоро могут быть использованы в качестве цитостатических препаратов [23,28].
Ингибирование роста опухолевых клеток флавоноидами в моделях invivo и invitro встречается во многих работах [41,68]. Эти исследования проводились как на химически-индуцированных опухолях [52], так и на опухолях вирусного происхождения [80]. Тем не менее эффекты, оказываемые флавоноидами на опухолевые клетки столь разнообразны, что поиск механизмов действия продолжается до сих пор.
Изобилие эффектов флавоноидов на метаболизм опухолевых клеток разделяют на несколько основных, определенных механизмов.
Флавоноиды вовлекаются в большое количество регулирующих путей, таких как рост, энергетический метаболизм, апоптоз, дифференцировка клетки, транскрипция, репарация ДНК, передача нервных импульсов, воспаление, и окислительный стресс [7,30,38].
Таким образом, флавоноиды могут действовать как антиоксиданты, ловушки свободных радикалов, ингибиторы ферментов, гормоны (в том числе и как медиаторы) или индукторы экспрессии генов.
Высокая подвижность электронов в ароматическом ядре флавоноидов объясняет их антиоксидантные свойства, тогда как структурное сходство флавоноидов со многими соединениями, участвующими в жизнедеятельности клетки, объясняет их ингибирующее действие на ферменты, связывание с цитоплазматическими и ядерными рецепторами гормонов и медиаторов, а так же на индукцию экспрессии генов. Примером последнего является индукция кумарином генов протеазы при отеках [58]. Высокая аффинность флавоноидов с ионами тяжелых металлов обеспечивает дополнительные возможности их влияния на работу ферментов. Рассмотрим некоторые из биологических активностей флавоноидов.
Некоторые флавоноиды ингибируют тирозинспецифические киназы [26]. В результате чего рост и пролиферация опухолевых клеток так же может замедляться [29]. Другая возможность - влиять на рост опухолевых клеток была обнаружекна при изучении работы Na+/K+-АТФазы.
Потребность опухолевых клеток в АТФ довольно высока и в итоге начинает превышать возможности его наработки клеткой. Главным источником АТФ, в условиях недостатка кислорода, что сопровождается бурным ростом опухолевых клеток, становится гликолиз. В процессе работы гликолитических ферментов концентрация молочной кислоты повышается, что приводит к снижению pH, положительно влияя на работу лизосомальных ферментов, но при этом ингибируются многие ферменты. Снижение концентрации АТФ может приводить к тому, что активность Na+/K+-АТФазы будет снижаться [74], что приведет к возрастанию в цитоплазме концентрации ионов Na+ . Таким образом, интенсивность транспорта глюкозы в клетку, которая является зависимой от градиента ионов Na+ , снижается и эффективность фосфорилирования АДФ падает.
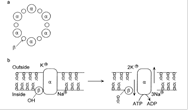
Рэкер с коллегами показал [35,70,71] (SpectorM., et.al., 1980a, 1980b;), что транспортная Na+ /K+ -АТФаза линии опухолевых клеток (HELA), в отличие от фермента в нормальных клетках, фосфорилируется по тирозиновому остатку регуляторной β-цепи. Ими было определено, что кверцетин дефосфорилирует фенольную группу тирозина в β-цепи транспортной Na+ /K+ -АТФаза (рис. 5). Это фактически ведет к ингибированию Na+ /K+ -АТФазы опухолевых клеток [70,71] и к нарушению ионного гомеостаза опухолевых клеток и снижение транспорта глюкозы.
Рис.5 Предположительный механизм действия кверцетина на работу Na+ /K+ -АТФазы. (из обзора Havsteen B.H., 2002) a . Контур гексамерного агрегата α- и β-цепей Na+ /K+ -АТФазы (по данным РСА). b . Регулирование Na +-насоса фосфорилированием β-субъединицы, катализируемое фосфокиназой (слева) и работа насос,а запусакаемая гидролизом АТФ (справа). c . Предположительный механизм дефосфорилирования тирозина β-субъединицы.
Ингибирование флавоноидами транспортера глюкозы в плазматической мембране опухолевых клеток было обнаружено и другими авторами [37,65,66]. Учитывая то, что регулирующая β-цепь митохондриального протонного насоса структурно схожа с β-цепью Na+ /K+ -АТФазы, можно предпологать, что протонный насос, вероятно, также регулируется реакцией фосфорилирования/дефосфорилирования и, соответственно, является чувствительным к флавоноидам [8,35].
Цитостатический эффект флавоноидов по отношению к опухолевым клеткам, наблюдаемый Рэкером [48], частично был приписан им к индукции этими соединениями апоптоза. Однако в дальнейшем этот факт стал интерпретироваться как результат воздействия на стресс-отвечающие гены, в особенности кодирующих БТШ [39,47]. Однако эффекты БТШ и кверцетина (или подобных ему флавоноидов) противоположны, потому как кверцетин способствует вхождению клетки в апоптоз, а БТШ способствуют выживанию клетки. И действительно, было обнаружено, что кверцетин ингибирует экспрессию БТШ-70, опосредованно через ингибирование активации промотора ФТШ (фактора теплового шока) [36]. Помимо кверцетина, флавоноид генистеин также ингибировал активацию HSF, но не предотвращал при этом его связывание с ДНК [59]. Вместо этого генистеин влияет на вторую стадию активации ФТШ - фосфорилирование, ингибируя активность фосфокиназы [2,57]. Так как БТШ вовлечены во многие клеточные процессы, например, клеточный цикл, дифференцирование, апоптоз [78], развитие и трансформацию, исследования регулирования активности ФТШ и БТШ является важным этапом исследования действия флавоноидов на опухолевые клетки. Роль БТШ как антагонистов индукции апоптоза под действием кверцетина до сих пор остается не понятна.
Кверцетин может действовать синергично с цитостатическими агентами и ингибиторами биосинтеза белков в индукции апоптоза. Циклогексимид, ингибитор трансляции белка, вызывает апоптоз у 40 ± 2 % клеток, уровень которого возрастает до 76 ± 2 % в присутствии кверцетина [25]. Аналогичный эффект наблюдается и с адриномициом D, ингибитором транскрипции, под действием которого уровнь апоптотических клеток возрастает от 19±3 % до 91 ± 5 % в присутствии кверцетина [33].
Люминол, пероксидаза хрена, HEPES, лецитин – производства «Sigma». Пероксид водорода, тиобарбитуровая кислота, фосфорная кислота, NaCl, CaCl2, MgCl2, FeSO4, глюкоза – «ЗАО Мосреактив» - Москва. Дигидрокверцетин – НПФ “Флавит”, ИБП РАН, Пущино.
В экспериментах использовали крыс-самцов линии Вистар весом 200 - 300 г. Крысы содержались в условиях вивария на стандартном рационе при свободном доступе к воде и пищи, при температуре 16-20°С в режиме естественной освещенности.
Макрофаги выделяли сразу после умерщвления крысы (по средствам декапитации) Крыса закреплялась на препаратном столике брюшком к верху, брюшко обрабатывалось 70% этиловым спиртом, производился надрез кожи вдоль туловища с паховой области до грудной клетки и поперёк в районе задних конечностей, образовавшееся лоскуты кожи закреплялись. Затем с помощью шприца внутрибрюшинно (не задевая кишечник) вводили 10-11 мл холодной среды RPMI-1640 с некоторым количеством воздуха. После этого массировали брюшную стенку в течении 2-3 минут, для отделения макрофагов перитониальной полости в суспензию. Затем, осторожно, не задевая кишечника, вводили иглу с правой стороны брюха животного и отбирали суспензию содержащую макрофаги. Суспензию сразу переносили в стерильную стеклянную пробирку и помешали в холодильник.
После выделения макрофаги подсчитывали в камере Горяева (в среднем выделяется около 1 мил. клеток в мл).
После выделения макрофаги концентрировали центрифугированием. Для этого пробирку, содержащую суспензию макрофагов помещают в охлаждённую до 4°С центрифугу и центрифугируют при 1000 об/мин в течении 10 мин. Получившейся осадок клеток ресуспендируют в 200 мкл солевой буфер и оставляют на холоду на 1 час.
Для измерения продукции активных форм кислорода в ответ на стимул применялся метод люминол зависимой хемилюминесценции, основанный на окислении люминола активными формами кислород с выделением аминофталата и испусканием кванта света. Для этого в ячейку помещали 500 мкл среды регистрации с pH=7.6, содержащей 0.9% NaCl; 5 mM HEPES; 5 mM глюкозы; 1 mM CaCl2 и 10-4 моль люминола, добавляли суспензию клеток и, через определённое время инкубации, добавлялся PMA (10-6 моль/л), в качестве стимула. Хемилюминесценцию регистрировали на люменометре “Биотокс -7”
Определение степени ингибирования процесса образования АФК в присутствие флавоноида в модельной биохимической системе, содержащей пероксид водорода, пероксидазу хрена и люминол, было выполнено на хемилюминометре «Биотокс 7» («Инженерный Центр – Экология», г. Москва, Россия). Измерение проводили при температуре 37°С, pH=7,3.
Среда для регистрации АФК содержала: NaCl -150 мМ, HEPES -5 мМ, глюкоза - 5 мМ, CaCl2 - 1 мМ, MgCl2 - 1 мМ, pH - 7,4 при температуре 37о С. Модельная система содержала: 0,5 мл среды регистрации, 250 мкМ люминола, 4 U/мл пероксидазы хрена и 30 мкМ пероксида водорода.
Антиоксидантная активность (АОА) оценивалась по снижению максимальной интенсивности ХЛ вдвое. При определении АОА антиоксидант вводился в модельную систему до добавления пероксида водорода. Величину АОА дигидрокверцетина (ДГК) определяли интерполяцией экспериментальных значений интенсивностей ХЛ от концентрации антиоксиданта в модельной системе. Для анализа полученных данных по АОА исследуемого соединения, нами была выбрана концентрация антиоксиданта (C50% ), которая снижала интенсивность хемилюминесценции вдвое, в отличие от принятой рядом авторов величины 1/C50% [81].
Влияние на процесс образования продуктов ПОЛ, таких как малоновый диальдегид (МДА) и монокарбонильные соединения, в присутствие флавоноида определялось по реакции образующихся альдегидов с тиобарбитуровой кислотой.
В пробирки, содержащие 1 мл раствора лецитина (N мг/мл), добавляли ДГК и сульфат железа (II) в концентрациях 0, 1, 5, 10 мМ для флавоноида и 0, 1, 5, 10 мМ для соли железа в разных комбинациях. Далее раствор липида инкубировался при 37о С в течение 16 суток и анализировался на содержание карбонильных соединений и ненасыщенных групп. Аналогичным образом проводили инкубацию растворов липида в присутствии 10 мМ пероксида водорода.
К 50 мкл суспензии липида добавляли 450 мкл раствора тиобарбитуровой кислоты (2,5 мг/мл) в 2% ортофосфорной кислоте. Полученный раствор инкубировался при 100 о С в течение 1 часа и затем окрашенный продукт экстрагировался 500 мкл н-бутанола. Из спиртового экстракта регистрировался спектр в диапазоне 450-650 нм (спектрофотометр UV-Vis “Specord-M40”, Carl Zeiss, Германия). Математическими методами определялась оптическая плотность при 460, 500 и 532 нм, которые характерны для максимумов поглощения соответствующих ТБК-КС (карбонильных соединений). Наличие пиков адсорбции, характерных для образования аддуктов с ТБК при 490 и 510 нм обусловлено образованием монокарбонильных соединений (альдегидов), реагирующих с ТБК, тогда как для продукта конденсации ТБК-МДА характерно поглощение при 532 нм [44, 46].
В качестве объекта исследования был выбран природный флавоноид – дигидрокверцетин. В силу своей природы, данный флавоноид, являясь полифенолом, способен проявлять ряд свойств характерных для данного класса соединений. В первую очередь все флавоноиды обладают свободными гидроксильными группами, благодаря чему водные растворы этих соединений обладают низкими значениями pH. Во-вторых, наличие близко расположенных гидрокси-групп способствует хеллатированию ионов металлов, ингибируя, таким образом, реакцию Фентона. В третьих возможность делокализации заряда при образовании радикала флавоноида, объясняет его антиоксидантные свойства. Данные три аспекта хорошо описывают биологическое действие флавоноида в условиях окислительного стресса в биологических системах.
Первым этапом наших исследований было изучение антиоксидантных свойств дигидрокверцетина. Антиоксидантная активность (АОА) определяется различными методами, в том числе наиболее часто для этой цели используют модельную систему: люминол-H2 O2 -катализатор, где в качестве катализатора могут выступать пероксидаза, гемоглобин или соли металлов переменной валентности. Под антиоксидантными свойствами соединения подразумевают его антиокислительную (АОА) и антирадикальную активности (АРА). Антиокислительная активность определяется различными методами, в том числе наиболее часто для этой цели используют модельную систему: люминол-H2 O2 -катализатор, где в качестве катализатора могут выступать пероксидаза, гемоглобин или соли металлов переменной валентности. В данной работе определяли АОА и АРА ингибиторов свободнорадикальных реакций в модельной биохимической системе, содержащей люминол, пероксидазу хрена и пероксид водорода.
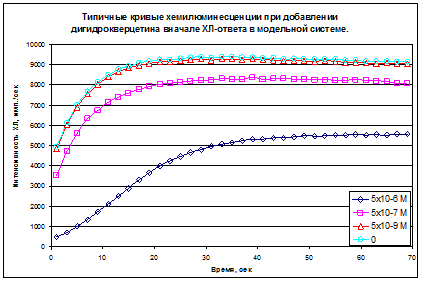
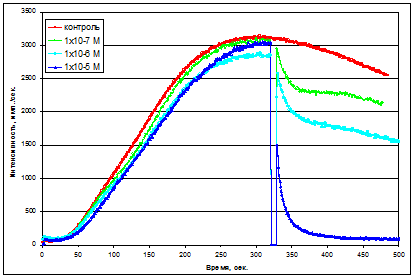
Рис.6 Типичные кривые интенсивности хемилюминесцентного ответа в модельной системе в зависимости от концентрации дигидрокверцетина (введение антиоксиданта до начала реакции).
Если рассмотреть модельную систему с точки зрения образования РФК, понятно, что в начальный период основной формой окислителя является перекись водорода, вследствие чего добавка антиоксиданта в начале ХЛ-ответа позволяет судить нам о его антиокислительных свойствах.
С другой стороны достижение равновесия, визуально наблюдаемого в максимуме хемилюминесценции, сопровождается взаимодействием антиоксиданта как с молекулярной формой (H2 O2 ), так и наиболее предпочтительнее с его радикальными формами, позволяя судить об антирадикальных свойствах.
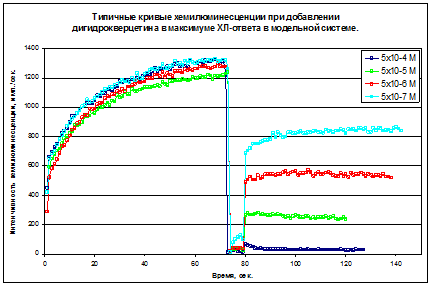
Антиоксидантные свойства флавоноидов (в том числе и для ДГК) напрямую зависят от их липофильных свойств, т.е. с уменьшением молекуляной массы увеличивается их АРА. Тем не менее, не только это является основополагающим для данной группы антиоксидантов. Такие производные, как пентаацетат ДГК и пентабензоат ДГК обладают слабой активностью, вследствие отсутствия свободных группировок, и единственно возможным путем реагирования со свободными радикалами может быть присоединение радикала по карбоксильной группе с образованием метастабильных радикалов орто-кислот, с дальнейшим отщеплением эфирной группировки (Шаталин Ю.В., и др. 2008). Альтернативный механизм реакции с подобными антиоксидантами является гидролитическое расщепление антиоксиданта до исходных компонентов и дальнейшая реакция их с радикальными формами. Второй путь является известным явлением, характерным для расщепления производных флавноноидов и эфиров полифенольных соединений в организме животных. Подобное расщепление выполняется рядом арилэстераз, присутствующих и в плазме крови. Но в модельных системах данный процесс маловероятен.
В качестве другой модельной системы была выбрана система, где в качестве источника генерации АФК были использованы полиморфноядерные лейкоциты (ПМЯЛ) здорового животного и опухоленосителя, которые в ответ на стимул (ФМА) способны продуцировать супероксид-анион с последующим молекулярным превращением его в другие активные формы кислорода. Такой подход позволяет оценить действие антиоксидантов на респираторный взрыв фагоцитов. В системе данного типа происходит взаимодействие антиоксидантов с радикальными формами кислорода.
В данной системе наблюдалось снижение чувствительности системы к возрастающему количеству антиоксиданта, что связано с насыщенностью им водной фазы и накоплением в липидном слое клеточной мембраны и что проявляется в расхождении между значениями между антиоксилительной активностью и антирадикальной активностью флавоноида на 2 порядка. Благодаря постоянной диффузии между двумя фазами и по мере окисления антиоксиданта в растворе, происходит обмен окисленных форм антиоксиданта на восстановленные из липидной фазы.
Скорость взаимодействия с АФК лимитируется только диффузионной составляющей. Для гидрофильных антиоксидантов (гипоксен и аскорбиновая кислота) такого эффекта не наблюдается, и сужение разностной гистограммы наблюдается только при 95% ингибировании хемилюминесценции (Шаталин Ю.В., и др. 2008).
В результате исследований было обнаружено, что концентрация антиоксиданта, необходимая для снижения ХЛ-ответа в клеточной системе, на порядок больше, чем в модельной биохимической системе. При действии гидрофобного антиоксиданта на клетки, происходит частичное распределение его в липидной компоненте мембраны, тем самым увеличивается концентрация антиоксиданта, требуемая для снижения АФК в водной фазе.
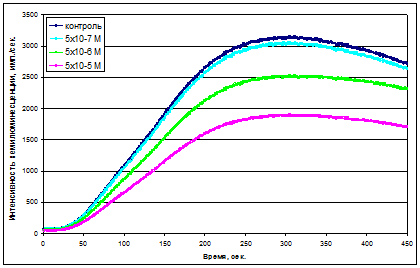
Рис.8 Типичные кривые изменения уровня РФК в максимуме хемилюминесценции в системе, содержащей фагоцитирующие клетки кровеносного русла здорового животного, при добавлении различных концентраций дигидрокверцетина (АРА).
Рис.9 Типичные кривые хемилюминесценции в системе, содержащей фагоцитирующие клетки здорового животного, при добавлении дигидрокверцетина.
Основные реакции, протекающие при этом в растворе, сопровождаются образованием более стабильных форм кислорода. Так для реакции с участием хиноновой группировки флавоноида происходит перенос электрона с супероксид аниона на антиоксидант:
O2 – + A = O2 + A– • ,
где А –хиноновая группировка флавоноида, а A– • - семихинонная форма хиноновой группировки.
(O2 – - ē = O2 ; E○ pH 7 = 560 мВ)
Реакции с участием аскорбиновой кислоты, α-токоферола как и ДГК так же может протекать через стадию элиминирования с образованием пероксида водорода:
O2 – + AH + H2 O = H2 O2 + A– • (•) + OH- ,
где AH / A– •(•) – восстановленная / окисленная форма антиоксиданта
(O2 – + H2 O + ē = HO2 – +OH– ; E○ щел = 408 мВ, E○ pH 7 = 822 мВ)
Окислительно-восстановительные потенциалы антиоксидантов приведены в таблица 4.
Тем не менее, реакция будет протекать, если будет выполняться следующее соотношение:
ln(Keq) = ln((A– • )(O2 (H2 O2 ))/(A(AH))(O2 – )) > 0;
В данном выражении, при прочих равных условиях, для исследуемых антиоксидантов соотношением (O2 (H2O2 ))/(O2 – ) можно пренебречь. Соотношение же (A–• )/(A(AH)) сильно зависит от растворимости исходных антиоксидантов в водной фазе - чем она ниже, тем ниже и ΔG, при условии (A–• ) << (A(AH)). Следовательно, величина ΔG (энергия Гиббса) при одинаковых условиях генерации АФК будет зависеть от концентрации антиоксиданта в водной фазе (A(AH)), которая, в свою очередь, зависит от константы распределения антиоксиданта между водной и липидной фазой, а так же от скорости диффузии из одной фазы в другую.
Низкая растворимость ДГК приводит к тому, что действующая концентрация антиоксиданта, находящаяся в водной фазе, значительно ниже, чем добавляемая в систему. Тем не менее, благодаря этим свойствам, данные соединения должны обладать высокой защитной способностью от перекисного окисления липидов, обрывая ветвление свободно радикальной цепи.
Сравнение потенциала окислительно-восстановительной реакции (термодинамическая составляющая), в которой участвует ДГК и растворимость в водной фазе (кинетическая составляющая) показало, что при исследовании АОА и АРА необходимо учитывать оба эти параметра. Низкий потенциал полуреакции восстановления хиноновой группировки до семихиноновой формы указывает на возможность обратной реакции, что проявляется, в ряде случаев, в виде наличия прооксидантных свойств.
Как видно из таблицы 4, ДГК обладает высокой антирадикальной активностью в биохимической модельной системе, и по своим свойствам сравним с аскорбиновой кислотой.
Таблица 4. Антиоксидантные свойства дигидрокверцетина в “биохимической” и “клеточной” системах. САРА– концентрация, соответствующая антирадикальной активности соединения; САОА – концентрация, соответствующая антиокислительной активности соединения; БХС – биохимическая модельная система (пероксидаза хрена – люминол – H 2 O 2 ); ФС – фагоцитсодержащая модельная система (лейкоциты крови здорового животного – люминол - ФМА).
| Антиоксиданты | САРА в БХС | САОА в БХС | САРА в ФС | САОА в ФС |
| α-токоферол | 2,24х10-5 | 3,41х10-5 | 2,43х10-4 | 3,14х10-5 |
| ДГК | 2,0х10-7 | 1,7х10-6 | 3,3х10-5 | 5,0х10-6 |
| АК | 1,8х10-7 | 5,2х10-7 | 1,1х10-5 | 1,7х10-6 |
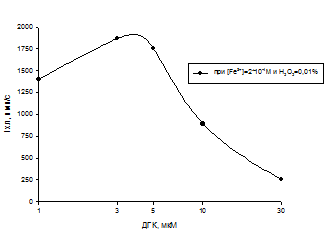
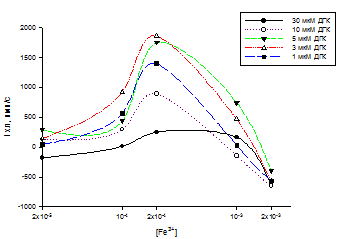
Следующим этапом нашей работы стало изучение антиоксидантной активности ДГК системе в которой в качестве катализатора выступало железо(III). В данной системе существует возможность реализации прооксидантного эффекта по механизму представленному справа. Нами был обнаружен эффект усиления уровня АФК по сравнению с контролем (рис 11). Т.е. в определенных концентрационных соотношениях был обнаружен мах прооксидантный эффект при Fe3+ = 200 мкМ (рис 13) и ДГК = 3 мкМ (рис 12).
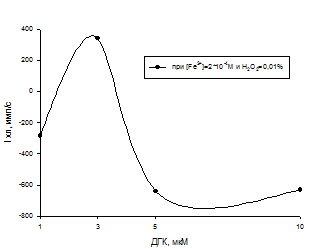
Рис.12 Зависимость ХЛ-ответа от С(ДГК)
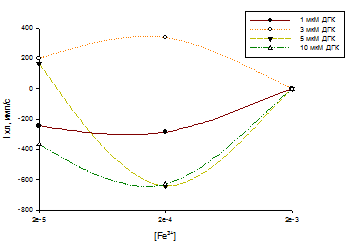
Рис.13 Зависимость ХЛ-ответа от С( Fe 3+ )
Сходные результаты были получены нами при переходе на систему генерации АФК перитонеальными макрофагами в присутствии железа. Это говорит в пользу того что протекающая реакция восстановления железа до активного двухвалентного состояния реализуется как в химической, таки и клеточной модельной системе. На рис. 14 показана трехмерная диаграмма с максимальным прооксидантным эффектом наблюдаемым при Fe3+ = 200 мкМ (рис 16) и ДГК = 3 мкМ (рис 15), что аналогично химической модельной системе: люминол-H2O2- Fe3+ .
Рис.15 Зависимость ХЛ-ответа от С(ДГК)
Рис.16 Зависимость ХЛ-ответа от С( Fe 3+ )
Влияние рН на процесс окисления липида в присутствии ДГК и его комплекса с железом (II).
Использование данной модельной системы: люминол-H2O2-катализатор, не является оптимальной для изучения про/антиоксидантых свойств гидрофобных соединений вследствие слабой растворимости в воде и высокого коэффициента распределения октанол-вода (для дигидрокверцетина LogP =1 .82±0.41). Поэтому в дальнейшем нами была использована модель окисления лецитина под действием кислорода воздуха и пероксида водорода.
В процессе реакции ДГК с активными формами кислорода (АФК) образуются промежуточные формы обладающие как про- так и антиоксидантной активностью (схема 1). Как видно из схемы под действием АФК наблюдается отрыв протона с образованием семихиноновой формы ДГК (I). Стабильность данной формы выше в условиях высоких концентраций ДГК и при высоких значениях pH, что приводит к образованию димерных форм семихинонов с распределением заряда. Дальнейшее окисление под действием АФК приводит к образованию хинона (II), который так же частично образуется в процессе реакции диспропорционирования. Хиноновая и семихиноновая формы проявляют прооксидантный эффект и способны генерировать АФК или отрывать по гомолитическому разрыву слабые водородные связи, преимущественно от гидроксильных групп. При низких значениях pH, окисление ДГК направляется по другому пути с образованием стабильных феноксильных радикалов, способных проявлять как прооксидантные, так и антиоксидантные свойства (III, IV).

Схема 1. Окислительно-восстановительные превращения дигидрокверцетина
Образующиеся феноксильные или генерируемые опосредовано через хиноновую/семихиноновую формы радикалы способны участвовать в реакции с липидом с образованием различных карбоксильных соединений а так же увеличение непредельных групп в липиде (схема 2). Как видно из схемы гомолитических отрыв C-H связи возможен только в присутствие высокоэнергитических гидроксил радикалов. Дальнейшие стадии образования спиртовой группы и дегидратация может протекать в присутствии более слабых окислителей. Дальнейшее окисление, сопровождающееся разрывом двойных связей и окислением их до соответствующих карбонильных соединений, протекает в присутствии пероксидов и катализируется в присутствии металлов переменной валентности, способных образовывать π-комплекс.
Схема 2. Основные пути формирования непредельных групп в липиде и образование альдегидов в процессе окисления
Нами было обнаружено, что в процессе окисления липида в присутствии ДГК, наблюдается накопление всех карбонильных производных, причем образование монокарбонильных соединений существенно ингибируется с ростом концентрации ДГК, относительно контрольного образца липида (данные не представлены). Тем не менее, накопление основного продукта, малонового диальдегида, от концентрации ДГК в липиде, имеет сложную зависимость (рис. 17 a).
Максимальное накопление малонового диальдегида в присутствии ДГК приходилось на 6-8 сутки, при этом доза зависимое ингибирование накопления МДА наблюдалось только в период до 4-х суток. Изменив систему окисления липида, добавив в качестве катализатора ПОЛ ионы металла переменной валентности, можно попытаться ответить на вопрос - является ли подобное изменение следствием прооксидантного эффекта ДГК.
Введение в образцы липида соли двухвалентного железа способствуют ускорению процесса распада гидропероксидов, а так же катализируют реакцию окисления непредельных связей в присутствии перекисей. В данном случае основным повреждающим агентом является образующиеся гидроксил радикалы. Предотвратить реакцию гидроксил-радикала с липидом невозможно, но возможно связать ионы железа, благодаря чему скорость образования радикалов существенно снизится.
В присутствии 20 мкМ сульфата жалеза (II) существенно изменялся процесс накопления карбонильных соединений. Доза зависимое ингибирование процесса накопления карбонильных соединений сохранялось до концентрации ДГК в системе 1 мг/мл, и далее наблюдалось существенное увеличение концентрации монокарбонильных соединений и малонового диальдегида на 50 и 100% соответственно (рис. 17 b).
Аналогичная “седловидная” форма зависимости накопления МДА от концентрации ДГК с течением времени сохраняется при концентрации железа 200 мкМ. Дальнейшее же увеличение концентрации железа приводило к смещению минимума седла в сторону больших концентраций ДГК и появлению в области концентрации ДГК 10 мкг/мл пика соответствующему наивысшей точки накопления МДА в системе. Таким образом, наблюдается наличие концентрационных границ для ДГК, за пределами которых данный флавоноид проявляет прооксидантный эффект, но по разным механизмам. По-видимому, при низкой концентрации ДГК (10 мкг/мл) и высокой концентрации железа (более 2 мМ) наблюдается накопление семихинона, способного проявлять прооксидантный эффект. При определенном соотношении ДГК/Fe2+ прооксидантный эффект наступал в районе высоких концентраций ДГК, что по-видимому связано с цикличным процессом окисления-восстановления железа, при котором окисленное железо (III) образующееся в процессе расщепления пероксидов, вновь восстанавливается до активного двухвалентного состояния.
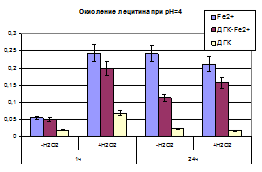
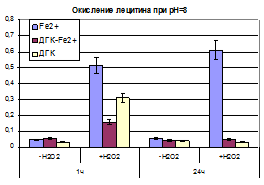
Условия окружения, в том числе и pH и источник экзогенных перекисей, так же может вносить вклад в изменение кинетики накопления продуктов ПОЛ, что наглядно можно проиллюстрировать в таблице 5.
На 1-м часу инкубации раствора содержащего липид и дигидрокверцетин, существенное ингибирования образования МДА, наблюдалось при значении pH 4, при котором дигидрокверцетин находится в полностью протонированной форме и по-видимому легче образует стабильный радикал при взаимодействии с АФК. При дальнейшей инкубации тенденция сохраняется. Но так же можно наблюдать тот факт, что комплекс ДГК-Fe2+более эффективно справляется с процессом ингибирования ПОЛ в щелочной области pH, тогда как при кислых значениях pH обладает прооксидантным эффектом.
Наличие в смеси дополнительного источника пероксидов – пероксида водорода, приводит к тому, что существенно ускоряются процесс ПОЛ в присутствии свободного железа, тогда как в присутствии комплекса этот процесс к 24 часу инкубации снижается до контрольной отметки.
Таблица 5. Концентрация МДА (% от контроля) образующегося при инкубации раствора лецитина в различных условиях в присутствии дигидрокверцетина, сульфата железа (II) и комплекса ДГК-Fe2+
| Инкубация раствора липида при 37о С и pH 8 в присутствии ингибитора/катализатора ПОЛ |
| Время инкубации | 1 часинкубации | 24 часа инкубации |
Концентрация
ингибитора/
катализатора ПОЛ
| Fe2+ | ДГК-Fe2+ | ДГК | Fe2+ | ДГК-Fe2+ | ДГК |
| 5мМ | 104±13 | 124±12 | 72±9 | 124±16 | 91±8 | 86±8 |
| 10мМ | 110±17 | 105±14 | 116±13 | 205±17 | 120±15 | 80±5 |
| Инкубация раствора липида при 37о С и pH 4 в присутствии ингибитора/катализатора ПОЛ |
| 5мМ | 117±14 | 106±12 | 40±4 | 519±37 | 241±18 | 49±4 |
| 10мМ | 120±14 | 82±8 | 12±2 | 745±54 | 329±24 | 50±4 |
| Инкубация раствора липида при 37о С и pH 8 в присутствии ингибитора/катализатора ПОЛ и 10 мМ пероксида водорода |
| 5мМ | 1098±140 | 339±27 | 662±33 | 1309±152 | 107±11 | 68±7 |
| 10мМ | 1109±78 | 450±54 | 169±15 | 515±42 | 124±9 | 79±8 |
| Инкубация раствора липида при 37о С и pH 4 в присутствии ингибитора/катализатора ПОЛ и 10 мМ пероксида водорода |
| 5мМ | 521±37 | 424±70 | 147±12 | 454±36 | 338±31 | 34±2 |
| 10мМ | 850±55 | 478±49 | 117±11 | 445±48 | 472±45 | 30±2 |
а b
Рис. 18 Окисление лецитина в различных условиях (а. значение рН 4; b . значение рН 8)
Эффективность ДГК в присутствии неорганического пероксида сохраняется и к 24 часу инкубации смеси активность ДГК даже превосходит аналогичный эффект в отсутствии пероксидов. Тем не менее, при pH 8 (рис 18b), к 1-му часу инкубации смеси, в присутствии 5 мМ ДГК, концентрация МДА соответствует эффекту 5 мМ Fe (II) при pH 4 (рис 18a), что говорит о наличии явного прооксидантного эффекта.
Таким образом, наличие прооксидантной активности ДГК можно ожидать в условиях высоких значений pH, а так же в присутствии металлов переменной валентности, но уже в кислых растворах.
1. Исследованы антиоксидантные свойства дигидрокверцетина на модельных биохимических и клеточных системах. Показано, что дигидрокверцетин проявляет антиоксидантную активность в концентрационном диапазоне (C50% ) от 3,3х10-5 М до 2,0х10-7 М.
2. Впервые показана прооксидантная активность комплекса ДГК-Fe(III) на модельных биохимической и клеточной системах и определены оптимальные концентрационные границы проявления данного эффекта.
3. На модели перекисного окисления липида (лецитина) обнаружено наличие прооксидантного эффекта у дигидрокверцетина и его комплекса ДГК/железо(II). Впервые показано, что оптимальными условиями проявления дигидрокверцетином антиоксидантных свойств являются низкие значения pH среды, тогда как для комплекса необходимо наличие нейтральных или щелочных значений pH.
4. Впервые обнаружено, что зависимость накопления малонового диальдегида в присутствии ДГК от времени имеет “седловидную” форму, что подтверждает наличие прооксидантного эффекта ДГК при определенных концентрациях и, по-видимому, наличие как минимум 2-х механизмов прооксиданого действия флавоноида в растворе.
1. Afanas'ev I. B., Ostrachovich E. A., Korkina L. G. Effect of rutin and its copper complex on superoxide formation and lipid peroxidation in rat liver microsomes // FEBS Lett. 1998. V. 425. № 2. P. 256–8.
2. Akiyama T., Ishida J., Nakagawa S., Ogawara H., Watanabe S., Itoh N., Shibuya M., Fukami Y. Genistein, a specific inhibitor of tyrosine specific protein kinases // J. Biol. Chem. 1987. V. 262. V. 5592–5.
3. Areias F.M., Rego A.C., Oliveira C.R., Seabra R.M. Antioxidant effect of flavonoids after ascor-bate/Fe2+ -induced oxidative stress in cultured retinal cells // Biochem. Pharmacol,- 2001,- Vol. 62.-P. 111-118.
4. Arora A., Byrem T.M., Nair M.G., Strasburg G.M. Modulation of liposomal membrane fluidity by flavonoids and isoflavonoids // Arch. Biochem. Biophys.- 2000.- Vol. 373.- P. 102-109.
5. Arora A., Nair M.G., Strasburg G.M. Structure-activity relationships for antioxidant activities of a series of flavonoids in a liposomal system // Free Radic. Biol. Med.- 1998.- Vol. 24,- P. 1355— 1363.
6. Aucamp J., Gaspar A., Hara Y., Apostolides Z. Inhibition of xanthine oxidase by catechins from tea (Camellia sinensis) // Anticancer Res.- 1997.- Vol. 17.- P. 4381-4385.
7. Barinaga M. Forging a path to cell death // Science. 1996. V. 273. P. 735–7.
8. Bertorello A.M., Aperia A., Walaas S.I., Nairn A.C., Greengard P. Phosphorylation of the catalytic subunit of Na+/K+-ATPase inhibits the activity of the enzyme // Proc. Natl. Acad. Sci. USA 1991. V. 88. P. 11359–62.
9. Beyer G., Melzig M.F. Effects of selected flavonoids and caffeic acid derivatives on hypoxanthine-xanthine oxidase-induced toxicity in cultivated human cells // Planta Med.- 2003- Vol. 69- P. 1125-1129.
10. Bors W., Heller W., Michel C, Saran M. Flavonoids as antioxidants: determination of radical-scavenging efficiencies // Methods Enzymol.- 1990.- Vol. 186,- P. 343-355.
11. Bors W., Michel С Antioxidant capacity of flavanols and gallate esters: Pulse radiolysis studies // Free Radic. Biol. Med.- 1999.- Vol. 27.- P. 1413-1426.
12. Brown J.E., Khodr H., Hider R.C., Rice-Evans C.A. Structural dependence of flavonoid interactions with Cu2+ ions: implications for their antioxidant properties // Biochem. J.- 1998.- Vol. 330.-P. 1173-1178.
13. Cao G., Sofic E., Prior R.L. Antioxidant and prooxidant behavior of flavonoids: structure-activity relationships // Free Radic. Biol. Med.- 1997.- Vol. 22.- P. 749-760.
14. Chedeville O., Tosun-Bayraktar A., Porte C. Modeling of fenton reaction for the oxidation of phenol in water // J. Autom. Methods Manag. Chem. 2005. V. 2005. P. 31–6.
15. Chen Z. Y., Chan P.T., Ho K. Y. et al. The antioxidant activity of natural flavonoids in governed by number and location of their aromatic hydroxyl groups // Chem. Phys. Lipids- 1996.- Vol. 79.- P. 157-163.
16. Cheng I.F., Breen K. On the ability of four flavonoids, baicalein, luteolin, naringenin, and quercetin, to suppress the Fenton reaction of the iron-ATP complex // BioMetals.- 2000.- Vol. 13.-P. 77-83.
17. Choi J.S., Chung H.Y., Kang S.S. et al. The structure-activity relationship of flavonoids as scavengers of peroxynitrite // Phytother. Res,- 2002.- Vol. 16.- P. 232-235.
18. Cortell J. M., Halbleib M., Gallagher A. V., Righetti T. L., Kennedy J. A. Influence of vine vigor on grape (Vitis vinifera L. Cv. Pinot Noir) and wine proanthocyanidins // J. Agric. Food. Chem. 2005. V. 53. № 14. P. 5798–808.
19. Cotelle N., Bernier J.L., Catteau J.P. et al. Antioxidant properties of hydroxy-flavones // Free Radic. Biol. Med.- 1996.- Vol. 20.- P. 35-43. 425.
20. Davies S.P., Reddy H., Caivano M., Cohen P. Specificity and mechanism of action of some commonly used protein kinase inhibitors // Biochem. J.- Vol. 351.- P. 95-105.
21. Decker E.A. Phenolics: prooxidants or antioxidants? // Nutr. Rev.- 1997- Vol. 55.- P. 396-407.
22. Deng W., Fang X., Wu J. Flavonoids function as antioxidants: by scavenging reactive oxygen species or by chelating iron? // Radiat. Phys. Chem. 1997.- Vol. 50.- P. 271-276.
23. Fang N., Casida J.E. Anticancer action of cube insecticide: correlation for rotenoid constituents between inhibition of NADH:ubiquinone oxidoreductase and induced ornithine decarboxylase activities // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 3380–3384.
24. Ferguson P. J., Kurowska E. M., Freeman D. J., Chambers A. F., Koropatnick J. In vivo inhibition of growth of human tumor lines by flavonoid fractions from cranberry extract // Nutr. Cancer. 2006. V. 56. № 1. P. 86–94.
25. Ferriola P.C., Cody V., Middleton E. Protein kinase C inhibition by plant flavonoids. Kinetic mechanisms and structure-activity relationships // Biochem. Pharmacol. 1989. V. 38. P. 1617–24.
26. Gansauge S., Gansauge F., Gause H., Poch B., Schoenberg M.H., Berger H.G. Induction of apoptosis in proliferating, human fibroblasts by oxygen radicals is associated with a p53 and p21waf [CIC] induction // FEBS Lett. 1997. V. 404. 6–10.
27. Gao Z., Huang K., Xu H. Protective effects of flavonoids in the roots of Scutellaria baicalensis Georgi agaist hydrogen peroxide-induced oxidative stress in HS-SYSY cells // Pharmacol. Res.-2001.- Vol. 43.- P. 173-178.
28. Gerritsen, M.E. Flavonoids: inhibitors of cytokine induced gene expression // Adv. Exp. Med. Biol. 1998. V. 439. P. 183–190.
29. Grunberger D., Banerjee R., Eisunger K., Oltz E.M., Efros L., Caldwell M., Estevez V., Nakanishi K. Preferential cytotoxicity on tumor cells by caffeic acid phenylethyl ester isolated from propolis // Experientia. 1988. V. 44. P. 230–2.
30. Habtemariam S. Flavonoids as inhibitors or enhancers of the cytotoxicity of tumor necrosis factor-alpha in L-929 tumor cells // J. Nat. Prod. 1997. V. 60. P.775–8.
31. Harbome J.B., Williams C.A. Advances in flavonoid research since 1992 // Phytochemistry.-2000.- Vol. 55.- P. 481-504.
32. Havsteen B. Flavonoids, a class of natural products of high pharmacological potency // Biochem. Pharmacol. 1983. V. 32. № 7. P. 1141–8.
33. Hockenbery D.M., Oltvai Z.N., Yin X.-M., Milliman C.L., Korsmeyer S.J. Bcl 2 functions in an antioxidant pathway to prevent apoptosis // Cell. 1993. V. 75. P. 241–51.
34. Hodnick W.F., Kung F.S., Roettger W.J. et al. Inhibition of mitochondrial respiration and production of toxic oxygen radicals by flavonoids. A structure-activity study // Biochem Pharmacol.-1986.- Vol. 35.- P. 2345-2357.
35. Horisberger J.-D., Jannin P., Reuben M.A., Lasater L.S., Chow D.C., Forte J.G., Sachs G., Rossier B.C., Geering K. The H+-ATPase b-subunit can act as a surrogate for the b-subunit of Na+/K+-pumps // J. Biol. Chem. 1991. V. 266. P. 19131–4.
36. Hosokawa N., Hirayoshi K., Kudo H., Takechi H., Aoike A., Kawai K., Nagata K. Inhibition of the activation of heat shock factor in vivo and in vitro by flavonoids // Mol. Cell Biol. 1992. V. 12. P. 3490–98.
37. Hume D.A., Weidemann M.J., Ferber E. Preferential inhibition by quercetin of mitogen-stimulated thymocyte glucose transport // Natl. Cancer Inst. 1979. V. 62. P. 1243–6.
38. Jager W., Zembsch B., Wolschann P., Pittenauer E., Senderowicz A.M., Sausville E.A., Sedlacek H.H., Graf J., Thalhammer T. Metabolism of the anticancer drug flavopiridol, a new inhibitor of cyclin dependent kinases, in rat liver // Life Sci. 1998. V. 62. P.1861–73.
39. Janoutova J., Buckiova D., Jelinek R. Interaction between quercetin and heat shock. A preliminary study on the chick embryo. // Folia Biol. Prague 1996. V. 42. P. 231–4.
40. Jung H.A., Jung M.J., Kim J.Y. et al. Inhibitory activity of flavonoids from Prunus davidiana and other flavonoids on total ROS and hydroxyl radical generation // Arch. Pharm. Res.- 2003- Vol. 26.-P. 809-815.
41. Kandaswami C., Perkins E., Solonink D.S., Drzewiecki G., Middleton E. Antiproliferative effects of citrus flavonoids on a human squamous cell carcinoma in vitro // Cancer Lett. V. 56. P. 147–152.
42. Kaneko Т., Matsuo M., Baba N. Inhibition of linoleic acid hydroperoxide-induced toxicity in cultured human umbilical vein endothelial cells by catechins // Chem. Biol. Intern.- 1998.- Vol. 114.-P. 109-119.
43. Kim D.O., Lee C.Y. Comprehensive study on vitamin С equivalent antioxidant capacity (VCEAC) of various polyphenolics in scavenging a free radical and its structural relationship // Crit. Rev. Food Sci. Nutr.- 2004.- Vol. 44.- P. 253-273.
44. Knight J. A., Pieper R. K., McClellan L. Specificity of the thiobarbituric acid reaction: its use in studies of lipid peroxidation // Clin. Chem. 1988. V. 34. № 12. P. 2433–8.
45. Kostyuk V. A., Potapovich A. I., Kostyuk T. V., Cherian M. G. Metal complexes of dietary flavonoids: evaluation of radical scavenger properties and protective activity against oxidative stress in vivo // Cell. Mol. Biol. (Noisy-le-grand). 2007. V. 53. № 1. P. 62–9.
46. Kosugi H., Kikugawa K. Reaction of thiobarbituric acid with saturated aldehydes // Lipids. 1986. V. 21. № 9. P. 537–42.
47. Kudo M., Naito Z., Yokoyama M., Asano G. Effects of quercetin and sunphenon on responses of cancer cells to heat shock damage // Exp. Mol. Pathol. 1999. V. 66. P. 66–75.
48. Kuriki Y., Racker E. Inhibition of (Na+, K+) adenosine triphosphatase and its partial reactions with quercetin // Biochem. J. 1976. V. 15. P. 4951–6.
49. Laughton M.J., Evans P. J., Moroney M.A. et al. Inhibition of mammalian 5-lipoxygenase and cyclooxygenase by flavonoids and phenolic dietary additives. Relationship to antioxidant activity and to iron ion-reducing ability // Вiochem. Pharmacol.- 1991.-Vol. 42.-P. 1673-1681.
50. Lien E.J., Ren S., Bui H.H., Wang R. Quantitative structure-activity relationship analysis of phenolic antioxidants // Free Radic. Biol. Med.- 1999.- Vol. 26.- P. 285-294.
51. MacGregor J.T., Jurd L. Mutagenicity of plant flavonoids: structural requirements for mutagenic activity in S. typhimurium // Mutat. Res.- 1978.- Vol. 54.- P. 297-309.
52. Markaverich B.M., Gregory R.R., Alejandro M.A., Kittrell F.S., Medina D., Clark J.H., Varma M., Varma R.S. Methyl p-hydroxyphenyllactate and nuclear type II binding sites in malignant cells: metabolic fate and mammary tumor growth // Cancer Res. 1990. V. 50. P. 1470–78.
53. Metodiewa D., Jaiswal A.K, Cenas N. et al. Quercetin may act as a cytotoxic prooxidant after its metabolic activation to semiquinone and quinoidal product // Free Radic. Biol. Med.- 1999.- Vol. 26.-P. 107-116.
54. Moskaug J.O., Carlsen H., Myhrstad M., Blomhoff R. Molecular imaging of the biological effects of quercetin and quercetin-rich foods // Mech. Ageing Dev.- 2004.- Vol. 125.- P. 315-324.
55. Mutoh M., Takahashi M., Fukuda K. et al. Suppression by flavonoids of cyclooxygenase-2 promoter-dependent transcriptional activity in colon cancer cells: structure-activity relationship // Jpn. J. Cancer Res.- 2000.- Vol. 91.- P. 686-691.
56. Nijveldt R.J., van Nood E., van Hoorn D.E. et al. Flavonoids: a review of probable mechanisms of action and potential applications// Am. J. Clin. Nutr- 2001- Vol. 74- P. 418-425.
57. Osada H., Magae J., Watanabe C., Isono K. Rapid screening method for inhibitors of protein kinase C // J. Antibiot. 1988. V. 41. P. 925–31.
58. Piller, N.B. The induction of controlled proteolysis in high protein oedemas by coumarin // Z. Lymphol. 1979. V. 3. P. 110–3.
59. Price B.D., Calderwood S.K. Ca2+ is essential for multistep activation of the heat shock factor in permeabilized cells // Mol. Cell Biol. 1991. V. 11. P. 3365–8.
60. Rice-Evans C.A., Miller N.J., Paganga G. Antioxidant properties of phenolic compounds // Trends Plant Sci.- 1997.- Vol. 2.-P. 152-159.
61. Robak J., Duniec Z., Rzadkowska-Bodalska H. et al. The effect of some flavonoids on non-enzymatic lipid oxidation and enzymatic oxidation of arachidonic acid // Pol. J. Pharmacol. Pharm.- 1986.- Vol. 38.- P. 483-491.
62. Robak J., Shridi F., Wolbis M., Krolikowska M. Screening of the influence of flavonoids on lipoxygenase and cyclooxygenase activity, as well as on nonenzymic lipid oxidation // Pol. J. Pharmacol. Pharm.- 1988.- Vol. 40.-P. 451-458.
63. Sahu S.C, Gray G.C. Lipid peroxidation and DNA damage induced by morin and naringenin in isolated rat liver nuclei // Food Chem. Toxicol- 1997- Vol. 35.- P. 443-447.
64. Sahu S.C, Gray G.C. Pro-oxidant activity of flavonoids: effects on glutathione and glutathione S-transferase in isolated rat liver nuclei // Cancer Lett.- 1996.- Vol. 104.- P. 193-196.
65. Salter D.W., Custead-Jones S., Cook J.S. Quercetin inhibits hexose transport in a human diploid fibroblast // J. Membr. Biol. 1978. V. 40. P. 67–76.
66. Salter D.W., Kimmich G.A., Randles J. Phloretin-like action of bioflavonoids on sugar accumulation capability of isolated intestinal cells // Membr. Biochem. 1978. V. 1. P. 221–37.
67. Santos A.C., Uyemura S.A., Lopes J.L. et al. Effect of naturally occurring flavonoids on lipid peroxidation and membrane permeability transition in mitochondria // Free Radic. Biol. Med.- 1998.-Vol. 24.-P. 1455-1461.
68. Scambia G., Ranelletti F.O., Benedetti Panici P., Piantelli M., Bonanno G., De Vincenzo R., Ferrandina G., Maggiano N., Capelli A., Mancuso S. Inhibitory effect of quercetin on primary ovarian and endometrial cancers and synergistic activity with cis-diamminedichloroplatinum (II) // Gynecol. Oncol. 1992. V. 45. P. 13–9.
69. Sichel G., Corsaro C, Scalia M. et al. In vitro scavenger activity of some flavonoids and melanins againstOj //FreeRadic.Biol.Med.- 1991.-Vol. 11.-P. 1-8.
70. Spector M., O’Neal S., Racker E. Phosphorylation of the beta subunit of Na +K+ -ATPase in Ehrlich ascites tumor by a membranebound protein kinase // J. Biol. Chem. 1980b. V. 255. P. 8370–3.
71. Spector M., O’Neal S., Racker E. Reconstitution of the Na +K+ pump of Ehrlich ascites tumor and enhancement of efficiency by quercetin // J. Biol. Chem. 1980a. V. 255. P. 5504–7.
72. Sugihara N., Arakawa T., Ohnishi M., Furuno K. Anti- and pro-oxidative effects of flavonoids on metal-induced lipid hydroperoxide-dependent lipid peroxidation in cultured hepatocytes loaded with alpha-linolenic acid // Free Radic. Biol. Med. 1999. V. 27. № 11–12. P. 1313–23.
73. Sugihara N., Arakawa Т., Ohnishi M., Furuno K. Anti- and pro-oxidative effects of flavonoids on metal-induced lipid hydroperoxide-dependent lipid peroxidation in cultured hepatocytes loaded with a-linolenic acid // Free Radic. Biol. Med.- 1999.- Vol. 27.- P. 1313-1323.
74. Umarova F.T., Khushbactova Z.A., Batirov E.H., Mekler V.M. Inhibition of Na + ,K( + )-ATPase by flavonoids and their inotropic effect. Investigation of the structure-activity relationship. // Membr. Cell Biol. 1998. V. 12. P. 27–40.
75. van Acker S. A., van Balen G. P., van den Berg D. J., Bast A., van der Vijgh W. J. Influence of iron chelation on the antioxidant activity of flavonoids // Biochem Pharmacol. 1998. V. 56. № 8. P. 935–43.
76. Van Acker S.A., de Groot M.J., van den Berg D.-J. et al. A quantum chemical explanation of the antioxidant activity of flavonoids // Chem. Res. Toxicol.- 1996.- Vol. 9.- P. 1305-1312.
77. Van Jaarsveld H., Kuyl J.M., Schulenburg D.H., Wiid N.M. Effect of flavonoids on the outcome of myocardial mitochondrial ischemia/reperfusion injury // Res. Commun. Mol. Pathol. Pharmacol.-1996.-Vol.91.-P.65-75.
78. Wei Y.Q., Zhao X., Kariya Y., Fukata H., Teshigawara K., Uchida A. Induction of apoptosis by quercetin: involvement of heat shock protein // Cancer Res. 1994. V. 54. P. 4952–7.
79. Zeng L.H., Wu J., Fung B. et al. Comparative protection against oxyradicals by three flavonoids on cultured endothelial cells // Biochem. Cell Biol.- 1997.- Vol. 75.- P. 717-720.
80. Zhu B.T., Liehr J.G. Quercetin increases the severity of estradiol-induced tumorigenesis in hamster kidney // Toxicol. Appl. Pharmacol. 1994. V. 125. P. 149–158.
81. Владимиров Ю. А., Шерстнев М. П., Азимбаев Т. К. Оценка антиокислительной и антирадикальной активности веществ и биологических объектов с помощью железоинициированной хелмилюминесценции // Биофизика. 1992. №37. С.1041–1047.
82. Ломбоева С.С., Танхаева Л.М., Оленников Д.Н. Динамика накопления флавонойидов в надземной части ортилии однобокой (orthilia secunda (L.) house) // Химия растительного сырья. 2008. №3. С.83-88
83. Шаталин Ю. В., Наумов А. А., Поцелуева М. М. Сравнительная характеристика антиоксидантных свойств гипоксена и дурохинона методом хемилюминесценции // Биофизика. 2008. Т. 53, № 1. С.100-106
|