Стимулы и сигнальные пути гипоксической силовой тренировки
Рассмотрены стимулы и сигнальные пути гипоксической силовой тренировки. Для гипертрофии мышц такими стимулами являются: рекрутирование ДЕ, клеточный отек, метаболические и ишемические стрессы, повреждения мышц. Рассмотрены пути и механизмы мышечной гипертрофии.
Wernbom M. Blood flow restricted resistance exercise: possible stimuli and signaling pathways // 8th International Conference on Strength Training, 2012 Oslo, Norway, Norwegian School of Sport Sciences. – P.25-28.
М. Вернборн
ГИПОКСИЧЕСКАЯ СИЛОВАЯ ТРЕНИРОВКА: ВОЗМОЖНЫЕ СТИМУЛЫ И СИГНАЛЬНЫЕ ПУТИ
1Lundberg Laboratory for Human Muscle Function, University of Gothenburg, Sweden.2Department of Physical Performance, Norwegian School of Sport Sciences, Oslo, Norway.
Введение
Было неоднократно показано, что силовые упражнения с небольшими отягощениями (~ 20-50% 1 RM) в сочетании с ограничением потока крови (BFR) с помощью манжет для измерения давления вызывают гипертрофию мышц у неподготовленных людей (33). Силовые упражнения с ишемией мышц (BFRRE) также часто называют силовой тренировкой с перекрытием кровотока или просто «окклюзионной тренировкой», они также могут вызывать увеличение силы и размера мышц в пожилом возрасте (15), а также и у спортсменов (30) и могут противодействовать атрофии мышц у здоровых людей, если они не нагружаются (5) и у пациентов, восстанавливающихся после хирургии передней крестообразной связки (23).
Большее количество потенциальных приложений гипоксической силовой тренировки (BFRRE) вызывает большой интерес как с практической точки зрения, так со стороны фундаментальных исследований, чтобы попытаться выяснить, как окклюзионная тренировка вызывает увеличение силы и размера мышц.
ФИЗИОЛОГИЯ ГИПОКСИЧЕСКОЙ СИЛОВОЙ ТРЕНИРОВКИ – ВОЗМОЖНЫЕ СТИМУЛЫ ДЛЯ ГИПЕРТРОФИИ
Рекрутирование двигательных единиц (ДЕ)
Традиционно считается, что при силовой тренировке гипертрофия в основном происходит в волокнах, которые были задействованы во время упражнения, и что гипертрофия в основном больше в волокнах типа II (быстро сокращающихся), чем в волокнах типа I (медленно сокращающихся) (17).
Гипоксическая силовая тренировка с небольшими отягощениями выполняемые «до отказа», может давать результат в виде высокого уровня мышечной активности, что показывает электромиография (ЭМГ). Например, Takarada и др. (29) показали, что ЭМГ двуглавой мышцы плеча во время силовых упражнений с небольшими отягощениями (40% от 1 RM), совмещенных с частичной окклюзией потока крови в мышцах почти равна наблюдаемой во время традиционной тренировки с большими сопротивлениями (80% от 1 RM). С учетом этого вывода, Wernbom et al. (34) показали, что во время гипоксической силовой тренировки с отягощением 30% от 1 RM при выполнении разгибания ноги в коленном суставе ЭМГ четырехглавой мышцы во время концентрической фазы достигает показателей, приближенных к 100% от 1 RM произвольного сокращения мышцы во время тренировок «до отказа». В совокупности, эти и другие исследования ЭМГ показывают, что мышечная активность во время утомительной гипоксической силовой тренировки может быть достаточно высокой для осуществления задействования большинства волокон как типа I, так и типа II.
Более подробно влияние гипоксической тренировки описано в моей книге "Гипертрофия скелетных мышц человека"
Задействование волокон типа II во время гипоксической силовой тренировки с небольшими отягощениями было подтверждено путем измерения креатинфосфата в пробах мышц (18) и (31) посредством фосфор-магниторезонансной спектроскопии (28). Интересно, что Takada et al. (28) сообщили, что лица, которые задействовали волокна типа II при гипоксической силовой тренировке, как правило, получали большее поперечное сечение мышц (CSA) за четыре недели гипоксической силовой тренировки, по сравнению с теми, кто не задействовал волокна типа II (~ 6% против ~ 4% роста в CSA). Таким образом, имеющиеся данные подтверждают высокую степень важности задействования двигательных единиц.
Клеточный отёк
Предполагалось, что клеточный отёк является анаболическим и антикатаболическим стимулом для скелетных мышц, и что это один из механизмов, благодаря которому гипоксическая силовая тренировка стимулирует рост мышц (2, 19). На сегодняшний день, однако, нет достаточных доказательств для того, чтобы сделать заключение, что клеточный отёк как таковой действует как гипертрофический стимул в скелетных мышцах, в то время как некоторые исследования показали положительный эффект клеточного отёка на гипертрофическую сигнализацию (6, 20) и синтез белка (6), другие не смогли продемонстрировать такой результат, хотя распад белка был слегка сокращён (8).
Метаболические и ишемические стрессы
Недавнее исследование (28) сообщило о сильной корреляции между показателями BFR-индуцированного метаболического стресса, такого как неорганический фосфат (Pi), pH, депротонированный фосфат (H2PO4-) и гипертрофией мышц. Самая сильная корреляция наблюдалась между сильным приростом неорганического фосфата и гипертрофией мышечных волокон.
Интересно, что Takada и др. (28) утверждали, что метаболический стресс является более важным, чем задействование волокон II типа, на основе сильных корреляций между индексами метаболического стресса и гипертрофией. Однако, можно также утверждать, что увеличение неорганического фосфата в значительной степени отражает задействование и общий уровень работы, и что механические параметры, такие как пик напряженности, растяжение и время напряжения мышц являются реальными переменными при работе. Таким образом, не совсем ясно, метаболический стресс сам по себе является фактором, который стимулирует рост мышц, или он может взаимодействовать с эффектами других стимулов (например, механическое напряжение, растяжение, клеточный отёк).
Тесно связаны с метаболическим стрессом стрессы, вызванные ишемией и реперфузией. Ишемические условия могут, конечно, усиливать изменения, вызванные упражнениями, в неорганический фосфате, pH, H2PO4-, и т.д. Кроме того, ишемия и реперфузия являются причиной увеличения активных форм кислорода и азота, которые могут иметь как выгодные (например, гипертрофия), так и пагубные последствия (например, атрофия) для скелетных мышечных волокон. Однако, в настоящее время доступна ограниченная информация о воздействии гипоксической силовой тренировки на производство активных форм кислорода и азота.
Повреждения мышц
До недавнего времени считалось, что гипоксическая силовая тренировка не вызывает повреждения мышц. Однако появление запаздывающих болезненных ощущений в мышцах (DOMS) после гипоксической силовой тренировки с небольшими отягощениями уже 6 лет назад было сообщено Wernbom et al. (32) и впоследствии Umbel et al. (31) и в рамках других исследований Wernbom et al. (34, 35). Кроме того, и Umbel et al. (31), и Wernbom et al. (35) сообщили о дополнительных фактах, указывающих на повреждения мышц (уменьшение момента силы мышц, мышечный отёк и проницаемость сарколеммы) после гипоксической силовой тренировки. Наконец, недавнее тематическое исследование наблюдало рабдомиолиз после одной сессии утомительной гипоксической силовой тренировки с небольшими отягощениями (14). Таким образом, представляется, что гипоксическая силовая тренировка может вызывать повреждения мышц при определенных обстоятельствах.
Основная причина повреждения мышц при гипоксической силовой тренировки неизвестна, но она может быть связана с временно низкими местными уровнями энергии в мышечных волокнах, которые вместе с мышечной деятельностью приводят к увеличению накопления кальция (Ca2 +), который в свою очередь активирует повреждающие пути (9).
Гипотеза автора настоящей работы заключается в том, что умеренные повреждения мышц могут быть важным фактором, стоящим за эффектом гипоксической силовой тренировки. Кроме того, можно предположить, что метаболический стресс, мышечный отек и механическое напряжение мышц (сокращение и/или растяжение) взаимодействуют, чтобы вызвать повреждение при гипоксической силовой тренировке. Повреждения мышц могут в свою очередь стимулировать сравнительно длительный эффект в виде отека, а также способствовать появлению фактора роста и активации и пролиферации клеток-сателлитов, приводящих к увеличению количества миоядер (миоядерное дополнение).
ПУТИ И МЕХАНИЗМЫ МЫШЕЧНОЙ ГИПЕРТРОФИИ ПРИ СИЛОВОЙ ТРЕНИРОВКЕ С ОГРАНИЧЕНИЕМ ПОТОКА КРОВИ
Млекопитающая/механистическая цель Рапамицинового (mTOR) пути
В регуляции роста мышц механистической целью рапамицина (mTOR) является протеинкиназа. Он существует в комплексах с другими белками, и на сегодняшний день были обнаружены два mTOR комплекса, mTOR комплекс 1 (mTORС1) и 2 (mTORС2). mTORС1 представляется наиболее важным для регуляции синтеза белка с помощью нижних эффекторов, таких как p70S6K (также называемый S6K), 4E-BP ́s и eEF2 (3, 24). Многочисленные исследования на сегодняшний день указывают, что активация mTOR необходима для индукции синтеза белка и гипертрофии скелетных мышц (3, 7, 12, 13).
Интенсивная сессия гипоксической силовой тренировки показала увеличение сигнализации mTOR-p70S6K через 1-3 часа после тренировки (10, 11, 37). Кроме того, предварительные данные свидетельствуют о том, что увеличение mTOR- p70S6K сигнализации может длиться 24 часа после тренировки (37). Это может частично объяснить, почему даже низкая частота (два-три занятия в неделю) гипоксической силовой тренировкой могут успешно стимулировать гипертрофию мышц.
Стимулы, которые активизируют увеличение mTOR сигнализации при гипоксической силовой тренировке в настоящее время неизвестны, но верхняя сигнализация может включать Akt/PKB и/или Akt/PKB-независимые пути, такие как митоген активированные протеинкиназы (МАРК).
МАРК пути
МАРК пути включают внеклеточные регулируемые киназы: (ERK)1/2, p38МАРК (p38) и семьи c-jun n-terminal киназ (JNK). Каждая из этих семей состоит из нескольких членов, и многие из них экспрессируются в скелетных мышцах. Важно, ВРК1/2, p38МАПК и JNK - было выявлено, что все они активируются при выполнении силовых упражнений с большими отягощениями (4, 16). Кроме того, было показано, что все три основные МАРК семьи вовлечены в mTOR сигнализацию в различных типах клеток, и было предположено, что они вовлечены в механически индуцированный мышечный рост. МАРК и их нижние эффекторы также могут влиять на синтез белка независимо от mTOR через, например, несколько важных молекул, таких как p70S6K, rpS6, MNKs и GSK3beta (Рис. 1).
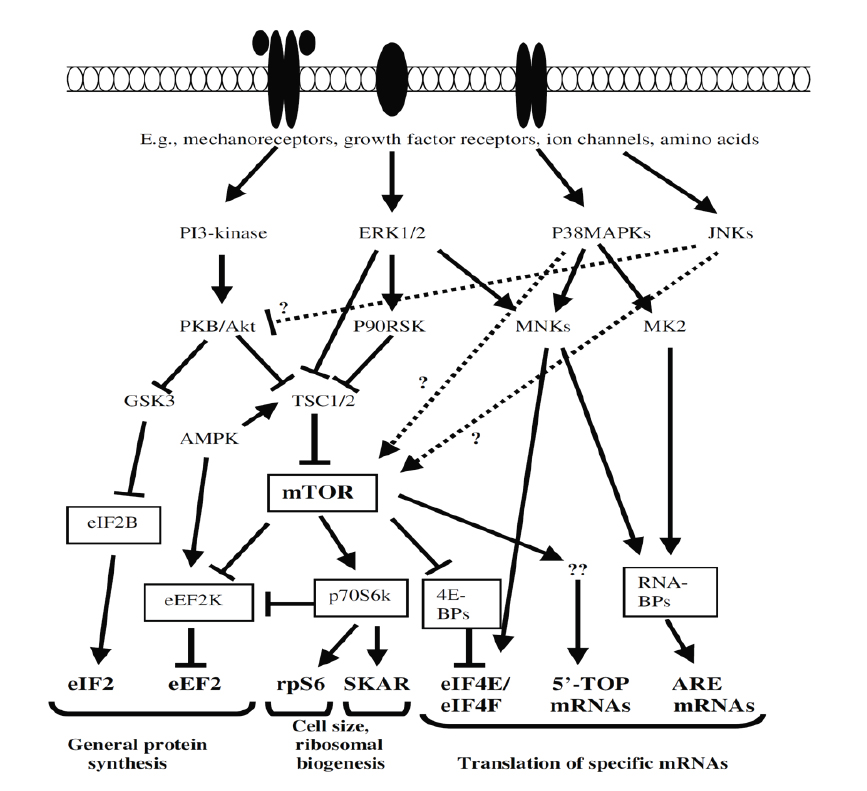
Рисунок 1. Некоторые из путей, регулирующих синтез мышечных белков. Изменено из Proud, 2007.
Тем не менее, все три основные МАРК также были причастны к атрофии мышц в ответ на различные атрофические стимулы. Эти, казалось бы, противоречивые результаты частично можно объяснить различиями в продолжительности и/или амплитуде MAPK сигнализации, и/или изоформами вовлеченных МАРК.
Ранее было продемонстрировано увеличение фосфорилирования ERK1/2 после интенсивных силовых тренировок с ограничением кровотока (10). Что касается реакции p38 на гипоксическую силовую тренировку, об этом в настоящее время имеется мало информации. Мы наблюдали увеличение фосфорилирования p38 через один час после интенсивной гипоксической силовой тренировки с несколькими подходами до отказа (37). Согласно осведомленности авторов, какого-либо исследования на сегодняшний день, изучившего ответ JNKs на гипоксическую силовую тренировку, не было проведено.
Пути расщепления белков
В дополнение к увеличению белкового синтеза гипертрофия мышц может также возникать, если распад мышечного белка (катаболизм белка) уменьшается. Некоторые из путей катаболизма белка включают убиквитин-протеасомную систему, лизосомную/аутофагную систему, калпаины и каспазы (27).
Две важных убиквитинлигазы скелетных мышц: atrogin-1/MAFbx и MuRF1, отвечают за увеличение распада белка через систему убиквитин протеасом. Atrogin-1 и MuRF1 находятся под контролем семьи FOXO транскрипционных факторов (FOXO1, FOXO3a и FOXO4) и NF-kappaB транскрипционного фактора (25, 27). Повышенная экспрессия FOXO1 или FOXO3a достаточна для вызова атрофии мышц (27).
Интересно, что ингибирование FOXO транскрипционной активности приводит к гипертрофии мышц, и это, как представляется, по крайней мере, отчасти зависит от увеличения синтеза мышечных белков, опосредованного mTOR путями (26). Таким образом, гипертрофические эффекты ингибирующих FOXOs скорее всего связаны как с уменьшением катаболизма, так и с увеличением синтеза белка.
В последнее время, было показано, что гипоксическая силовая тренировка приводит к уменьшению mRNA FOXO3a, Atrogin-1 и MuRF1 через восемь часов после тренировки (21). Таким образом, можно предположить, что сниженные содержания FOXO3a и убиквитинлигаз являются частью механизмов, стоящих за длительной mTOR сигнализацией, наблюдаемой после интенсивной гипоксической силовой тренировки (37).
Активация клеток-сателлитов и миоядерное дополнение
В недавнем исследовании, проведенном Nielsen et al. (22) было продемонстрировано заметное увеличение количества клеток-сателлитов и миоядер после краткосрочного периода гипоксической силовой тренировки высокой интенсивности. Интересно, что количество клеток-сателлитов и миоядер коррелировали с площадью поперечного сечения мышечных волокон до и после период тренировки. Для получения более подробной информации см. статью Per Aagaards.
Кроме того, используя аналогичный протокол гипоксической силовой тренировки, мы показали повышение количества клеток-сателлитов уже после одной сессии гипоксической силовой тренировки (Wernbom et al, в печати). Механизмы, отвечающие за это увеличение, могут включать нанесение вреда путям, РОС/RNS, высвобождение фактора роста, и т.д. (см. выше).
Заключение
Несмотря на низкие нагрузки, стимулы и сигнальные пути, участвующие в гипоксической силовой тренировке индуцирующие гипертрофию мышц, как представляется, во многом похожи на те, что участвуют при тренировках с большими отягощениями, то есть, при высоком уровне активности мышц. Некоторая степень повреждения/ремоделирования мышц, активирует пути, приводящие к увеличению белкового синтеза и снижению катаболизма белка, а также пролиферации клеток-сателлитов, увеличивающих количество миоядер.
Литература
1) Abe T, et al., Int J Kaatsu Training Res 2005; 1: 7-14.
2) Abe T, et al., Int J Kaatsu Training Res 2005; 1: 71-76.
3) Baar K, et al., Essays Biochem 2006; 42: 61-74.
4) Boppart MD, et al., J Appl Physiol. 1999; 87: 1668-1673.
5) Cook S, et al., J Appl Physiol 2010; 109: 341-9.
6) Darling RL, et al., [Abstract]. Appl Physiol Nutr Metab 2011; 36 (S2): S311.
7) Drummond MJ, et al., J Physiol 2009; 587: 1535-1546.
8) Fang CH, et al., JPEN 1998; 22: 115-119.
9) Fredsted A, et al., Exp Physiol 2005; 90: 703-714.
10) Fry CS, et al., J Appl Physiol 2010; 108: 1199-1209.
11) Fujita S, et al., J Appl Physiol 2007; 103: 903-910.
12) Goodman CA, et al., J Physiol 2011; 589: 5485-5501.
13) Hornberger TA, et al., Proc Natl Acad Sci U S A 2006; 103: 4741-4746.
14) Iversen E, Røstad V. Clin J Sport Med 2010; 20: 218-219.
15) Karabulut M, et al., Eur J Appl Physiol 2010; 108: 147-155.
16) Karlsson HK, et al., Am J Physiol Endocrinol Metab 2004; 287: E1-7.
17) Kraemer WJ, et al., Exerc Sport Sci Rev 1996; 24: 363-397.
18) Krustrup P, et al., Scand J Med Sci Sports 2009: 19: 576-584.
19) Loenneke JP, et al., Med Hypotheses 2012; 78: 151-154.
20) Low SY, et al., J Physiol 1996: 495: 299–303.
21) Manini TM, et al., Acta Physiol 2011; 201: 255-263.
22) Nielsen JL, et al., J Physiol 2012 Jul 16. [Epub ahead of print]
23) Ohta H, et al., Acta Orthop Scand 2003; 74: 62-68.
24) Proud CG. Biochem J 2007; 403: 217-234.
25) Reed SA, et al., Biochem Biophys Res Commun 2011; 405: 491-496.
26) Reed SA, et al., FASEB J. 2012; 26: 987-1000.
27) Sandri M., Physiology 2008; 23: 160-170.
28) Takada S, et al., J Appl Physiol 2012; 113: 199-205.
29) Takarada Y, et al., J Appl Physiol 2000; 88: 2097-2106.
30) Takarada Y, et al., Eur J Appl Physiol 2002; 86: 308-314.
31) Umbel JD, et al., Eur J Appl Physiol 2009; 107: 687-695.
32) Wernbom M, et al., J Strength Cond Res 2006; 20: 372-377.
33) Wernbom et al., Scand J Med Sci Sports 2008; 18: 401-416.
34) Wernbom M, et al., J Strength Cond Res 2009; 23: 2389-2395.
35) Wernbom M, et al., Eur J Appl Physiol 2012; 112: 2051-2063.
36) Wernbom M, et al., Eur J Appl Physiol 2012; 112: 3447-3449.
37) Wernbom M, et al., unpublished.
Перевод – Токмакова Е.П.
Редакция – Самсонова А.В.
2012_Wernborn_perevod.pdf
Комментариев нет:
Отправить комментарий