С утра до ночи — целый день
Часы считает палки тень.
Но если ночью Солнце спит,
То время, может быть, стоит?
Часы считает палки тень.
Но если ночью Солнце спит,
То время, может быть, стоит?
Всю историю идей и концепций в геронтологии можно вкратце охарактеризовать как историю поисков «часов» старения. В разное время в качестве таких «часов» побывали все эндокринные железы — гонады, надпочечники, щитовидная железа, гипофиз.
А известный отечественный геронтолог В.М. Дильман полагал, что время жизни отсчитывает главный «дирижер» эндокринного оркестра, расположенный в основании головного мозга, — гипоталамус.
Вместе с тем в природе существует естественный механизм, определяющий все ритмы живых организмов, — это смена дня и ночи, света и темноты. Вращение нашей планеты вокруг своей оси и одновременно вокруг Солнца отмеряет календарные сутки, сезоны и годы, с которыми сверяют продолжительность жизни ее обитатели.
Природа снабдила живые организмы устройством, способным воспринимать световую информацию и преобразовывать ее в сигналы, управляющие ритмами организма. Центральная часть этого устройства — верхний придаток головного мозга, эпифиз.
Древние анатомы назвали его шишковидной (пинеальной) железой за сходство с сосновой шишкой. Основная функция эпифиза — передача информации о световом режиме окружающей среды во внутреннюю среду организма.
Так в организме поддерживаются физиологические ритмы, обеспечивающие адаптацию к условиям внешней среды. У рыб, земноводных, рептилий и птиц свет проходит через тонкий череп, а эпифиз обладает способностью непосредственного восприятия световых сигналов (возможно, поэтому его и называют «третьим глазом»).
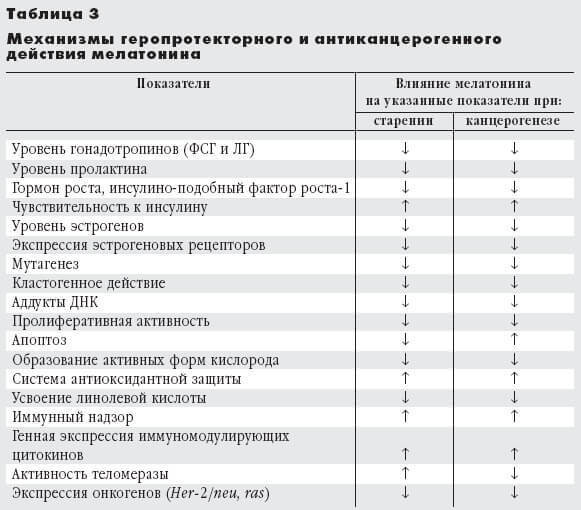
Рис. 1. Структурная формула мелатонина
У млекопитающих световая информация, воспринимаемая особыми клетками сетчатки глаз, передается в эпифиз по нейронам супрахиазматического ядра (СХЯ) гипоталамуса через ствол верхней грудной части спинного мозга и симпатические нейроны верхнего шейного ганглия. В темноте сигналы от СХЯ усиливают синтез и высвобождение норадреналина из симпатических окончаний.
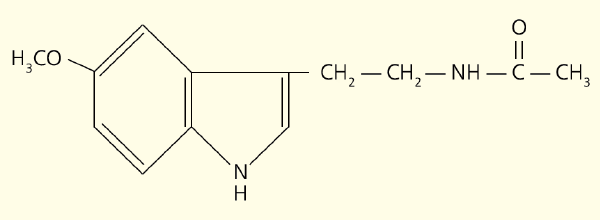
В свою очередь этот нейромедиатор возбуждает рецепторы, расположенные на мембране клеток эпифиза (пинеалоцитов), стимулируя синтез мелатонина (рис. 1). Этот основной гормон эпифиза — производное биогенного амина, серотонина, образующегося из поступающей с пищей аминокислоты триптофана. Активность ферментов, участвующих в превращении серотонина в мелатонин, подавляется освещением. Вот почему этот гормон синтезируется в темное время суток, когда его уровень в крови максимален, а в утренние и дневные часы — минимален (рис. 2).
Рис. 2. Биосинтез и суточный ритм мелатонина
В организме присутствует и экстрапинеальный (образующийся вне эпифиза) мелатонин. Это открытие принадлежит российским исследователям Н.Т. Райхлину и И.М. Кветному: в 1974 г. они обнаружили, что в клетках червеобразного отростка кишечника синтезируется мелатонин. Затем выяснилось, что этот гормон образуется и в других отделах желудочно-кишечного тракта, во многих других органах — печени, почках, надпочечниках, желчном пузыре, яичниках, эндометрии, плаценте, тимусе, а также в лейкоцитах, тромбоцитах и в эндотелии.
Биологическое действие экстрапинеального мелатонина реализуется непосредственно там, где он образуется. Синтез гормонов негормональными клетками подтверждает гипотезу эволюционной древности гормонов, которые, видимо, появились еще до обособления эндокринных желез. Вопрос о том, является ли этот путь синтеза гормона фотонезависимым, до сих пор окончательно не решен.
Световой режим, мелатонин и регуляция суточных биоритмов
Если эпифиз уподобить биологическим часам организма, то мелатонин можно сравнить с маятником, снижение амплитуды колебаний которого приводит к остановке этих часов. Пожалуй, точнее уподобить эпифиз солнечным часам, в которых мелатонин играет роль тени от гномона — стержня, отбрасывающего тень от солнца. Днем солнце высоко и тень коротка (уровень мелатонина минимален), в середине ночи — пик синтеза мелатонина эпифизом и секреции его в кровь. Важно, что мелатонин имеет околосуточный (циркадианный) ритм, т. е. единицей его измерения служит суточное вращение Земли вокруг своей оси.
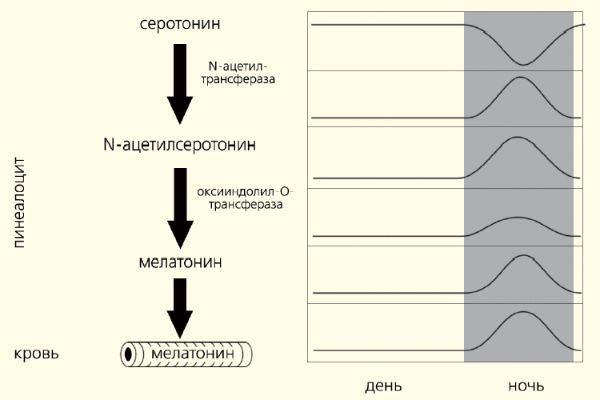
Все биологические ритмы строго подчиняются основному водителю, расположенному в супрахиазматических ядрах гипоталамуса. Их молекулярный механизм образуют «часовые» гены (Per1, Per2, Per3, Cry-1, Cry-2, Clock, Bmal1/Mop3, Tim и др.). Показано, что свет напрямую влияет на работу тех из них, что обеспечивают циркадианный ритм. Эти гены регулируют активность генов ключевого клеточного цикла деления и генов апоптоза. Гормоном-посредником, доносящим руководящие сигналы до органов и тканей, собственно, и служит мелатонин.
Характер ответа регулируется не только его уровнем в крови, но и продолжительностью ночной секреции. Кроме этого, мелатонин обеспечивает адаптацию эндогенных биоритмов к постоянно меняющимся условиям среды (рис. 3). Регулирующая роль этого гормона универсальна для всех живых организмов, о чем свидетельствует его присутствие и четкая ритмичность синтеза у всех животных, начиная с одноклеточных.
Рис. 3. Синхронизация биоритмов
Благодаря своим амфифильным свойствам (растворяется в воде и в жирах) мелатонин преодолевает все тканевые барьеры, свободно проходит через клеточные мембраны. Минуя систему рецепторов и сигнальных молекул, взаимодействуя с ядерными и мембранными рецепторами, он влияет на внутриклеточные процессы. Рецепторы к мелатонину обнаружены в различных ядрах гипоталамуса, сетчатке глаза и других тканях нейрогенной и иной природы.
У здоровых детей концентрация мелатонина в крови постепенно нарастает вплоть до года и сохраняется на достаточно высоком уровне до пубертатного периода. У ребят младшего возраста ночью количество мелатонина выше, чем днем, примерно в 40 раз. У маленьких детей этот гормон выполняет две функции: продлевает сон и подавляет секрецию половых гормонов. В период полового созревания количество циркулирующего в крови гормона снижается, причем наиболее отчетливо именно в период наступления половой зрелости. Разница между его ночной и дневной концентрацией сокращается до 10 раз. Отмечено, что у детей с замедленным половым созреванием уровень мелатонина более высокий. Если содержание гормона продолжает оставаться высоким (в пять и более раз выше возрастной нормы), половое созревание затягивается надолго.
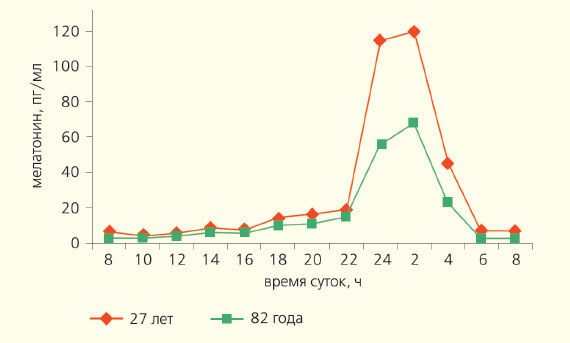
Вероятно, благодаря мелатонину взрослые люди видят эротические сны. Не без его участия сон переходит в «быструю стадию» (парадоксальный сон) и в памяти оживают яркие эмоциональные переживания, в том числе и связанные с сексом. У людей в возрасте 60–74 года большинство физиологических показателей претерпевают положительный фазовый сдвиг циркадианого ритма примерно на 1,5–2 ч вперед. У лиц старше 75 лет нередко возникает десинхронизация секреции многих гормонов, температуры тела, сна и некоторых ритмов поведения, что может быть связано с эпифизом, функция которого при старении угнетается (рис. 4).
Рис. 4. Суточный ритм концентрации мелатонина (пг/мл) в крови мужчин разного возраста. По оси ординат — мелатонин, пг/мл; по оси абсцисс — время суток, ч.
Если эпифиз — солнечные часы организма, то любые изменения длительности светового дня должны сказываться на его функциях и, в конечном счете, на скорости старения. В ряде работ показано, что нарушение фотопериодичности может существенно сокращать продолжительность жизни. Американские исследователи М. Хард и М. Ральф обнаружили, что золотистые хомячки с особой мутацией в гене tau, отвечающем за генерацию ритмических сигналов в супрахиазматическом ядре гипоталамуса, жили на 20% меньше, чем контрольные. Когда же в головной мозг мутантных хомячков имплантировали клетки гипоталамуса от здоровых зверьков, нормальная продолжительность жизни восстанавливалась. Разрушение супрахиазматических ядер приводит к сокращению продолжительности жизни животных. Нарушение функции некоторых циркадианных генов вызывает преждевременное старение и развитие различных патологических состояний, включая увеличение чувствительности мышей к развитию опухолей (табл. 1).
Репродуктивная функция
После изобретения электрического освещения свет в ночное время (его часто называют световым загрязнением) стал существенной частью современного образа жизни (рис. 5), приводя к серьезным расстройствам поведения и состояния здоровья, включая сердечно-сосудистые заболевания и рак. Согласно гипотезе «циркадианной деструкции», такое изменение светового режима нарушает эндогенный суточный ритм, подавляет ночную секрецию мелатонина и снижает его концентрации в крови. Тщательно проведенные исследования показали, что освещенность в 1,3–4,0 лк монохромного синего света или в 100 лк белого света подавляет продукцию мелатонина эпифизом (рис. 6).
Рис. 5. Вид Земли из космоса ночью
У лабораторных грызунов искусственное увеличение длительности светового периода на 2–4 ч продлевает продолжительность эстрального (овуляторного) цикла и в некоторых случаях нарушает его. При постоянном (24 ч/сут) воздействии света у большинства мышей и крыс очень быстро наступает состояние, эквивалентное климаксу у женщин. В яичниках таких животных обнаруживают кисты и гиперплазию клеток, продуцирующих половые гормоны. Вместо циклической секреции гонадотропинов, пролактина, эстрогенов и прогестерона, характерной для нормального репродуктивного периода, эти гормоны образуются ациклически, вызывая гиперпластические процессы в молочных железах и матке. Имеются данные, что воздействие света ночью сокращает длительность менструального цикла у женщин с длинным (более 33 дней) циклом: так, среди обследованных медицинских сестер, часто работающих в ночную смену, у 60% он стал короче (25 дней), а около 70% жаловались на его сбои. У крыс с нарушением овуляции снижается толерантность к глюкозе и чувствительность к инсулину. Установлено, что постоянное освещение увеличивает у них порог чувствительности гипоталамуса к угнетающему действию эстрогенов. Этот механизм — ключевой в старении репродуктивной системы, и у самок крыс, и у женщин. Итак, влияние света ночью приводит к ановуляции и ускоренному выключению репродуктивной функции у грызунов и к дисменорее у женщин.
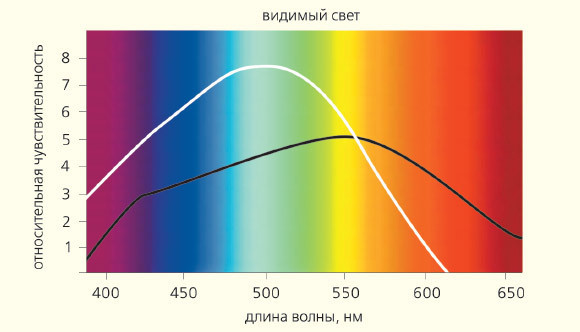
Рис. 6. Солнечный спектр и чувствительность клеток сетчатки — колбочек (цветная кривая) и палочек — к свету разной длины волны
Воздействие постоянного света усиливает перекисное окисление липидов в тканях животных и уменьшает общую антиокислительную и супероксиддисмутазную активности, тогда как применение мелатонина угнетает перекисное окисление липидов, особенно в головном мозге. Антиоксидантный эффект мелатонина, открытый Р. Рейтером в 1993 г., подтвержден в многочисленных исследованиях. Основная направленность такого действия гормона — защита ядерной ДНК, протеинов и липидов, которая проявляется в любой клетке живого организма и в отношении всех клеточных структур. Антиоксидантная активность мелатонина связана с его способностью нейтрализовать свободные радикалы, в том числе образующиеся при перекисном окислении липидов, а также с активизацией глутатионпероксидазы — мощного эндогенного фактора ферментативной защиты от радикального окисления. В ряде экспериментов доказано, что мелатонин нейтрализует гидроксильные радикалы активнее, чем такие антиоксиданты, как глутатион и маннитол, а в отношении пероксильных радикалов он в два раза сильнее, чем витамин Е.
Сменная работа и здоровье
В настоящее время в некоторых отраслях промышленности число людей, работающих посменно, довольно значительно: так, в США их 20%, а в большинстве стран Европейского Экономического Сообщества — 15–20% от общего количества. Очевидные проблемы со здоровьем среди сменных рабочих включают нарушения сна, метаболизма и толерантности к липидам, желудочно-кишечные заболевания, увеличение случаев сердечно-сосудистых заболеваний, возможно и развитие диабета. В этой группе чаще, чем у рабочих дневных смен, наблюдается ожирение, высокий уровень триглицеридов и холестерина, низкая концентрация липопротеинов высокой плотности. С другой стороны, имеются доказательства, что такой метаболический синдром служит фактором риска не только сердечно-сосудистых заболеваний, но и злокачественных опухолей.
Имеются сведения о гораздо большем количестве смертей от злокачественных новообразований у сменных рабочих со стажем не менее 10 лет по сравнению с рабочими дневных смен. В Дании в большом исследовании (около 7 000 обследуемых в каждой группе) показано, что вечерняя работа достоверно увеличивает риск развития рака молочной железы у женщин в возрасте от 30 до 54 лет. Аналогичные наблюдения отмечены в Финляндии и США при обследовании стюардесс на предмет рака молочной железы. Установлено также, что риск рака возрастает с учащением ночной бессонницы, увеличением уровня ночного освещения и при работе в ночную смену. В последнем случае риск также возрастал с увеличением стажа работы (табл. 2). В Норвегии при анализе данных о здоровье почти 45 тыс. медицинских сестер установлено, что показатель дополнительного риска рака молочной железы у работавших по ночам в течение 30 и более лет составил 2,21. Подобная картина в отношении рака толстой кишки обнаружена у длительно работавших по ночам жителей Сиэтла. Получены данные об увеличенном риске рака толстой кишки и рака прямой кишки у женщин, работающих на радио и телеграфе.

В 2003 г. Е. Шернхаммер и ее коллеги, проанализировав данные о состоянии здоровья 79 тыс. медсестер, обнаружили, что у работающих в ночные смены более высокий риск рака молочной железы. Рак толстой и прямой кишки встречаются чаще у рабочих, имеющих не менее трех ночных смен в месяц в течение 15 и более лет. Сообщают об увеличении риска рака простаты у скандинавских пилотов авиалиний в зависимости от количества продолжительных рейсов. Механизмы, лежащие в основе увеличенного риска рака среди ночных рабочих и летных экипажей, могут быть связаны с нарушением циркадианных ритмов и вынужденным воздействием света ночью, что и приводит к сокращению выработки мелатонина, известного биологического блокатора канцерогенеза.
Воздействие света и канцерогенез
Еще в 1964 г. немецкий исследователь В. Йохле отметил, что у мышей при круглосуточным освещении количество опухолей молочной железы и обусловленных ими смертей значительно больше, чем у животных, находящихся при обычном режиме. Аналогичная закономерность прослеживалась и в отношении других опухолей. В 1966 г. сотрудник Московского онкологического научного центра И.О. Смирнова обнаружила гиперпластические процессы в молочной железе и мастопатии у 78–88% самок крыс через 7 мес. после начала воздействия постоянного освещения. По данным И.А. Виноградовой, при содержании крыс при постоянном освещении до 18-месячного возраста доживает чуть больше половины самок, тогда как в комнате со стандартным режимом освещения к этому сроку были живы почти 90% животных. Спонтанные опухоли обнаружены у 30% крыс, содержавшихся при постоянном освещении, против 16% при стандартном режиме.
В опытах, проведенных в нашей лаборатории Д.А. Батуриным, у самок мышей, несущих ген рака молочной железы HER-2/neu, в результате постоянного освещения наблюдалось значительно больше аденокарцином молочной железы по сравнению с находящимися в стандартных условиях. Эффект был пропорционален интенсивности освещения. Воздействие постоянного освещения значительно ускоряло возрастные нарушения репродуктивной функции и существенно усиливало спонтанный канцерогенез у мышей линии СВА. Постоянное освещение, начатое в возрасте 30 дней, приводило к ускоренному развитию спонтанных аденокарцином эндометрия у крыс линии BDII/Han.
В 1965 г. И.К. Хаецкий из киевского Института проблем онкологии впервые сообщил о стимулирующем влиянии постоянного освещения на вызванный введением 7,12-диметилбензантрацена (ДМБА) канцерогенез молочных желез у крыс. При содержании животных с момента рождения при постоянном или стандартном освещениях количество аденокарцином молочных желез у крыс, получивших ДМБА в возрасте 55 дней, составило соответственно 95 и 60%. Применение мелатонина существенно задерживало развитие индуцированных опухолей в обеих группах.
В наших опытах введение крысам, содержащимся в обычных условиях, другого канцерогена, N-нитрозометилмочевины (НММ), привело к появлению у 55% животных аденокарцином молочных желез. При постоянном освещении количество этих новообразований значительно увеличивалось, а их латентный период уменьшался. У таких крыс ночью в сыворотке крови возрастала концентрация пролактина, а содержание мелатонина уменьшалось по сравнению с аналогичными показателями у крыс, находящихся в стандартных условиях.
В работе французских исследователей показано, что нарушение у крыс циркадианных ритмов, вызванное постоянным светом, стимулировало канцерогенез в печени, индуцируемый N-нитрозодиэтиламином. А.В. Панченко также отмечал, что при постоянном освещении у крыс увеличивалось количество аденокарцином в восходящем и нисходящем отделах толстой кишки при введении 1,2-диметилгидразина (ДМГ) по сравнению с крысами, содержащимися в стандартных условиях и также получившими инъекции этого канцерогена.

Мы совместно с Д.Ш. Бениашвили изучали влияние постоянного освещения на трансплацентарный канцерогенез, индуцируемый N-нитрозоэтилмочевиной. Крыс на протяжении всей беременности и вскармливания потомства содержали в комнате с круглосуточно включенным светом, после чего крысят переводили на обычный режим. Выяснилось, что даже кратковременное воздействие постоянного света стимулировало рост индуцируемых опухолей нервной системы и почек у потомства по сравнению с потомством крыс, находящихся в стандартных условиях. Таким образом, постоянное освещение активирует индуцированные химическими канцерогенами опухоли различных локализаций.
Недавно у больных раком молочной железы (в 95% случаев) обнаружены изменения в активности трех часовых генов (PER1, PER2, PER3). Это может привести к нарушению контроля над нормальным циркадианым ритмом и таким образом увеличить выживание раковых клеток и усилить неопластический процесс. В настоящее время пока неясно, уникален ли ген Per2 в качестве «супрессора опухоли» или имеются другие часовые гены с подобной противоопухолевой функцией. Механизм подавления роста опухоли также пока неясен, но имеется важное наблюдение — раковые ткани определенно связаны со специальными часовыми генами. В течение 2006 г. вышло еще шесть работ, свидетельствующих о нарушениях функций часовых генов у больных раком ряда других локализаций.
Данные, полученные на крысах и людях, показывают, что и в опухолях, и у самих особей значительно изменяются циркадианнные ритмы. Так, в наших экспериментах у крыс, имеющих рак толстой кишки, вызванный 1,2-диметилгидразином, нарушался циркадианный ритм мелатонина в сыворотке крови, в активности пинеалоцитов и содержании биогенных аминов в супрахиазматическом ядре гипоталамуса и преоптической области. Таким образом, экологические и генетические факторы, повреждающие системный и/или местный циркадианный ритм, могут ставить под угрозу временное регулирование деления клеток и таким образом усиливать рост опухоли.
Антистрессорные эффекты мелатонина
Эпифиз — важный элемент антистрессорной «обороны» организма, и мелатонину отводится в этом важная роль фактора неспецифической защиты. У высокоорганизованных животных и тем более человека пусковым моментом при развитии стресса служат негативные эмоции. Мелатонин способствует ослаблению эмоциональной реактивности. К отрицательным последствиям стресса можно отнести усиление свободно-радикального окисления, в том числе и перекисного окисления липидов, повреждающего клеточные мембраны. Стресс обязательно сопровождается обширными сдвигами в эндокринной сфере, которые в первую очередь затрагивают гипоталамо-гипофизарно-надпочечниковую систему. Участие мелатонина носит «поправочный» характер: гормон подключается к эндокринной регуляции только в случае резких отклонений в работе надпочечников.
Существует целая серия доказательств неблагоприятного влияния хронического стресса на иммунную систему. В частности, у лиц, длительное время переживающих психотравмирующую ситуацию, снижается уровень Т-лимфоцитов в крови. В этой ситуации мелатонин оказывает как прямое действие на иммунокомпетентные клетки, так и опосредованное, через гипоталамус и другие нейроэндокринные структуры.
Хронический стресс (например, связанный с болью или иммобилизацией) вызывает рассогласование суточных биоритмов, при этом возникают проблемы со сном, изменяется ЭЭГ, нарушается секреция ряда биологически активных соединений. И хотя основным «водителем ритма» в организме служит не эпифиз, а супрахиазматическое ядро гипоталамуса, оба этих образования взаимодействуют при посредничестве мелатонина (рецепторы к нему есть в клетках СХЯ), который способен ограничивать ход «спешащих часов» основного ритмоводителя.
Мелатонин, старение и развитие опухолей
Итак, в опытах на животных с индуцированным химическим канцерогенезом мелатонин тормозил рост опухолей различной локализации (молочной железы, шейки матки и влагалища, кожи, подкожной клетчатки, легких, эндометрия, печени, толстой кишки), что говорит о широком спектре его антиканцерогенного действия. Данные этих экспериментов на животных хорошо согласуются с результатами клинических наблюдений. Так, канадские исследователи обобщили результаты 10 работ, в которых использовали мелатонин для лечения онкологических больных с солидными формами опухолей. У 643 пациентов, принимавших мелатонин, относительный риск смерти снизился до 0,66, причем серьезных побочных эффектов препарата в течение года не зарегистрировали.
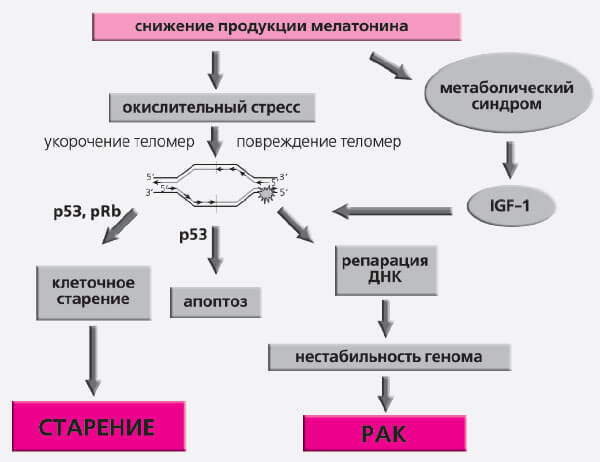
В последнее время активно обсуждаются возможные механизмы ингибирующего действия мелатонина на канцерогенез и старение. Установлено, что он эффективен на системном, тканевом, клеточном и субклеточном уровнях (табл. 3), препятствуя старению и раку. На системном уровне мелатонин снижает продукцию гормонов, способствующих этим процессам, стимулирует иммунный надзор, предупреждает развитие метаболического синдрома. Одновременно подавляется продукция свободных радикалов кислорода и активируется антиоксидантная защита. Мелатонин тормозит пролиферативную активность клеток и повышает уровень апоптоза в опухолях, но уменьшает его в нервной системе, угнетает активность теломеразы. На генетическом уровне он подавляет действие мутагенов и кластогенов, а также экспрессию онкогенов (рис. 7).
Рис. 7. Молекулярные механизмы влияния света и мелатонина на старение и рак
Все эти данные говорят о важной роли эпифиза в развитии рака. Угнетение его функции при постоянном освещении стимулирует канцерогенез. Эпидемиологические наблюдения относительно увеличения риска рака молочной железы и рака толстой кишки у рабочих ночных смен соответствуют результатам экспериментов на грызунах. Применение эпифизарного гормона угнетает канцерогенез у животных и при обычном световом режиме, и при постоянном освещении. Значит, мелатонин может оказаться весьма эффективным для профилактики рака, особенно в северных регионах, где летом всегда светло («белые ночи»), а в течение долгой полярной ночи всюду горит электрический свет.
В отличие от многих гормонов, действие мелатонина на клеточные структуры зависит не только от его концентрации в крови и межклеточной среде, но и от исходного состояния клетки. Это позволяет считать мелатонин универсальным эндогенным адаптогеном, поддерживающим баланс организма на определенном уровне и способствующим адаптации к непрерывно меняющимся условиям окружающей среды и локальным воздействиям на организм.
В настоящее время во многих странах выпускаются препараты мелатонина, которые зарегистрированы в качестве лекарств или как биологически активные добавки. Сегодня уже накоплен некоторый опыт их применения при лечении различных заболеваний, прежде всего при нарушениях сна, язвенной болезни желудка и двенадцатиперстной кишки, гипертонической болезни.
В многочисленных исследованиях показано, что мелатонин замедляет процессы старения и увеличивает продолжительность жизни лабораторных животных — дрозофил, плоских червей, мышей, крыс. Определенный оптимизм вызывают публикации о его способности повышать устойчивость к окислительному стрессу и ослаблять проявления некоторых ассоциированных с возрастом заболеваний людей, таких как макулодистрофия сетчатки, болезнь Паркинсона, болезнь Альцгеймера, гипертоническая болезнь, сахарный диабет. Всесторонние клинические испытания этого гормона существенно расширят его применение для лечения и профилактики возрастных заболеваний и, в конечном счете, преждевременного старения. опубликовано econet.ru
Автор: В. Н. Анисимов, доктор медицинских наук

Комментариев нет:
Отправить комментарий